Meer dan de helft van de gevallen van dementie wordt tegenwoordig geclassificeerd als de ziekte van Alzheimer - een chronische neurodegeneratieve ziekte die geleidelijk de cognitie en het geheugen van een persoon aantast.
Tot op heden werd gedacht dat het werd veroorzaakt door genetische en verouderingsfactoren, waarbij de schurken en hoofdschuldigen van de ziekte worden toegeschreven aan de seniele plaques en de neurofibrillaire klitten, die leiden tot neuro-inflammatie en achtereenvolgens neuronafsterving.
Een nieuwe theorie over de oorzaken van de ziekte van Alzheimer schijnt echter een licht in de hemel van het medisch onderzoek.
De theorie is dat genetica en veroudering niet de enige factoren zijn die verantwoordelijk zijn voor de vorming van amyloïde klonten - het eiwit dat zich ophoopt tussen neuronen en de ziekte van Alzheimer veroorzaakt - maar dat het ook een reactie kan zijn op een infectie met microben.
Laten we een neurologische schaal nader bekijken om het hele plaatje te begrijpen van wat er in een brein met Alzheimer gebeurt. Er zijn twee belangrijke verschijnselen aan de hand.
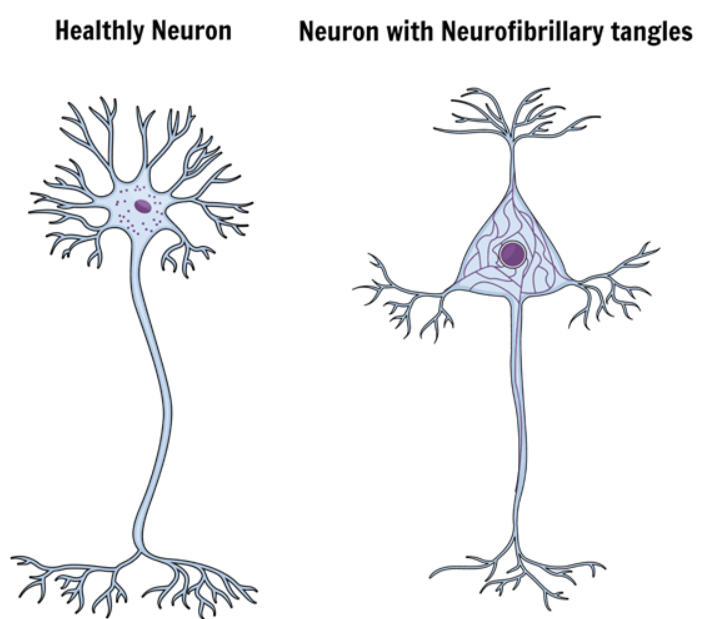
Een eiwit genaamd tau is verantwoordelijk voor het handhaven van stabiliteit door steun te geven aan microtubuli in neuronen. In hersenen die aan de aandoening lijden, wordt tau biochemisch gewijzigd door een reactie die hyperfosforylaatreactie wordt genoemd.
Het resultaat van deze verandering zijn onoplosbare stukjes eiwit in het neuron, die het hele systeem afbreken en de neuroncellen doden.
Deze onoplosbare stukjes tau-eiwit aggregeren met elkaar en vormen de neurofibrillaire klitten.
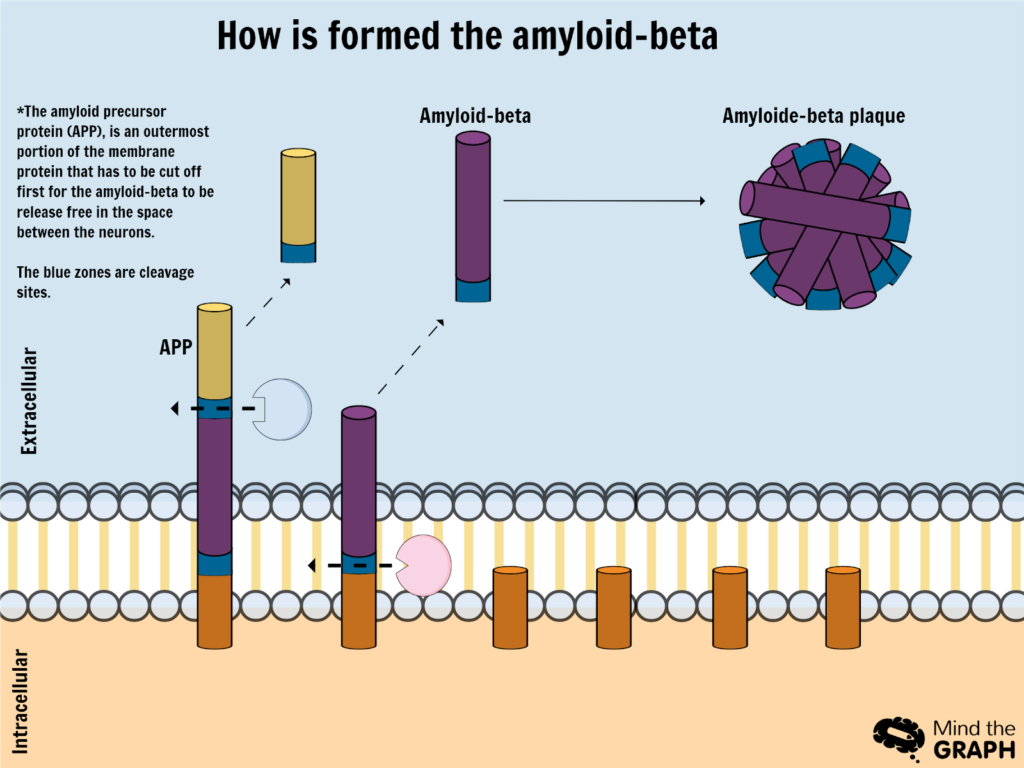
De seniele plaques zijn gemaakt van amyloïde-β peptiden. Een eiwit dat aanwezig is in neuronenmembranen (pre-amyloïde) ondergaat een splitsingsproces dat resulteert in vrije stukjes amyloïde-β buiten de neuronen*.
Deze stukjes zouden door speciale cellen en enzymen via fagocytose uit het buitenste neuronmedium moeten worden gereinigd, maar door genetische of verouderingsfactoren gebeurt dit proces niet efficiënt genoeg, wat leidt tot vrije stukjes onoplosbare amyloïd-β-eiwitten die tot plaques gaan aggregeren.
De amyloïde plaques zijn het meest bestudeerd en besproken als oorzaak van de ziekte van Alzheimer. Maar wetenschappers bevestigen ook dat de neurofibrillaire tangles rechtstreeks verband houden met het verloop van de ziekte.
Wetenschappers vonden ook amyloïde klonten in gezonde pos-mortem hersenen. Dat betekent dat in gezonde oude hersenen het schoonmaakproces ook minder efficiënt verloopt, maar niet zo veel als in hersenen met Alzheimer.
Daarom is een groot aantal van deze seniele plaques en neurofibrillaire tangles kenmerkend voor de ziekte van Alzheimer; zij worden uiterst giftig voor de hersenen en veranderen de efficiëntie en de kwaliteit van de synapsen.
Getroffen personen vertonen symptomen als geheugenverlies, verwarring over tijd en plaats, depressie, angst, taal- en communicatieproblemen, stemmingsinstabiliteit en andere.
In de nieuwe voorgestelde theoriezijn de amyloïde plaques een beschermingsmechanisme van de hersenen tegen besmetting door microben.
Het amyloïde-β-gen is aanwezig in een groot deel van de gewervelde groep en het is bij verschillende soorten gedurende verscheidene generaties bewaard gebleven, wat betekent dat het een nuttige en belangrijke rol voor ons lichaam zou moeten hebben, en niet alleen als iets schadelijks fungeert - als het niet iets waardevols of heilzaams was, zou het gen allang verdwenen zijn via het evolutionaire pad.
Wetenschappers gingen achter duizenden postmortale hersenen van mensen met Alzheimer aan.
Hoewel zij moeilijkheden ondervonden bij het analyseren van deze soorten hersenen vanwege de slechte conditie, waren zij in staat om informatie te bestuderen en te verzamelen om later enkele mogelijke triggers van microben voor te stellen.
Deze triggers zijn verdedigingsmechanismen tegen sommige soorten menselijke herpesvirussen, zoals herpesvirus 1, 6A en 7, en drie bacteriën, Chlamydia pneumonie, Borrelia burgdorferi, Porphyromonas gingivalis.
De theorie is dat het beta-amyloïde aanvankelijk een defensieve functie heeft, waarbij de microben die zich naar de hersenen begeven, worden ingesloten en een mogelijke infectie of ziekte wordt tegengehouden.
Zoals gezegd verliezen de hersenen door verouderingsfactoren hun vermogen om de amyloïden effectief op te ruimen. Het idee van de functie van amyloïden kan dus helemaal verkeerd zijn; het is waarschijnlijk betrokken bij een soort antimicrobiële bescherming tegen indringers in de hersenen, en wordt geclassificeerd als antimicrobiële peptide.
Wetenschappers hebben positieve resultaten behaald door aan te tonen dat β-amyloïde micro-organismen van enkele veel voorkomende ziekten kan doden.
Bovendien wordt in een ander onderzoek, dat in 2007 begon en in 2022 afloopt, aan de universiteit van Columbia in New York een antiviraal geneesmiddel getest bij patiënten met herpes simplex virus 1 en lichte Alzheimer, om te zien of het geneesmiddel de progressie van de ziekte kan vertragen.
Voorlopig kunnen we alleen maar het beste hopen en de resultaten afwachten.
Deze nieuwe theorie wordt nog steeds niet door alle wetenschappers aanvaard. Veel wetenschappers beweren dat zelfs als deze nieuwe theorie wordt bewezen, genetische factoren en slechte mutaties nog steeds de hoofdoorzaak van de ziekte zullen zijn.
De ziekte van Alzheimer is nog steeds een aandoening met zeer weinig wetenschappelijke kennis over de werkelijke oorzaken ervan; er is geen genezing en er zijn niet veel therapeutische behandelingsmogelijkheden. Als deze theorie waar blijkt te zijn, zou dit de eerste stap kunnen zijn in de richting van betere behandelingen. Go wetenschap!
Referenties
ABBOTT, A. Zorgen infecties voor sommige gevallen van Alzheimer? Natuur, v. 587, n. 7832, p. 22-25, 4 nov. 2020.
CECÍ, K. et al. Biomarkers bij de ziekte van Alzheimer. Geriatrie, gerontologie en veroudering, v. 6, n. 3, p. 273-282, 2012.
MAKIN, S. De amyloïde hypothese op proef. Natuur, v. 559, n. 7715, p. S4-S7, 25 jul. 2018.
YOO, K.-Y.; PARK, S.-Y. Terpenoïden als potentiële geneesmiddelen tegen de ziekte van Alzheimer. Moleculen, v. 17, n. 3, p. 3524-3538, mrt. 2012.
___
Als je een infographic moet maken voor wetenschappelijke doeleinden - zoals ik - in Mind the Graph kun je elk soort infographic maken die je nodig hebt en wilt. Het platform is er om van wetenschappers ontwerpers te maken om hun impact te vergroten! Doe mee op het platform, klik hier!

Abonneer u op onze nieuwsbrief
Exclusieve inhoud van hoge kwaliteit over effectieve visuele
communicatie in de wetenschap.