Kræft har længe været en vanskelig og forskelligartet sygdom forårsaget af ændringer i individets DNA, der aktiverer onkogener og inaktiverer tumorsuppressorer, hvilket også forårsager epigenom-dysregulering, som er ansvarlig for at koordinere normal genekspression.
For at opsummere er kræft en cellesygdom, der forårsager ændringer i metabolisme og cellestruktur, hvilket får disse celler til at blive ødelagt til det punkt, hvor de ikke længere fungerer korrekt og undgår værtens forsvarsmekanismer.
Et stort antal eksperter og fagfolk bruger deres karriere på at undersøge kræft for helt at forstå alle dens kompleksiteter og tvetydigheder. At lære, hvordan genomet ændrer sig, hvordan cellen tilpasser sig, og hvordan sygdommen opstår, er en af de kritiske faktorer for at udvikle mere effektive behandlingsvalg og forbedre resultaterne for kræftpatienter.
CRISPR-terapi har etableret sig som en teknik til at undersøge cellefunktion, og den har haft en betydelig indflydelse på kræftforskning, hvilket har resulteret i nye fund, der forventes at fremskynde diagnose og behandling.
Hvad er CRISPR-terapi?
Siden forskere opdagede, at ændringer i DNA forårsager kræft, har de ledt efter en metode til at rette op på sådanne ændringer gennem DNA-manipulation. Og en af de metoder, man har fundet, er CRISPR-terapi.
CRISPR-behandling kan redigere DNA i menneskeceller på samme måde som en ekstremt præcis og let håndterbar saks. CRISPR redigerer gener ved forsigtigt at klippe i DNA og derefter systematisk lade DNA'et reparere.

Hvordan fungerer CRISPR-terapi?
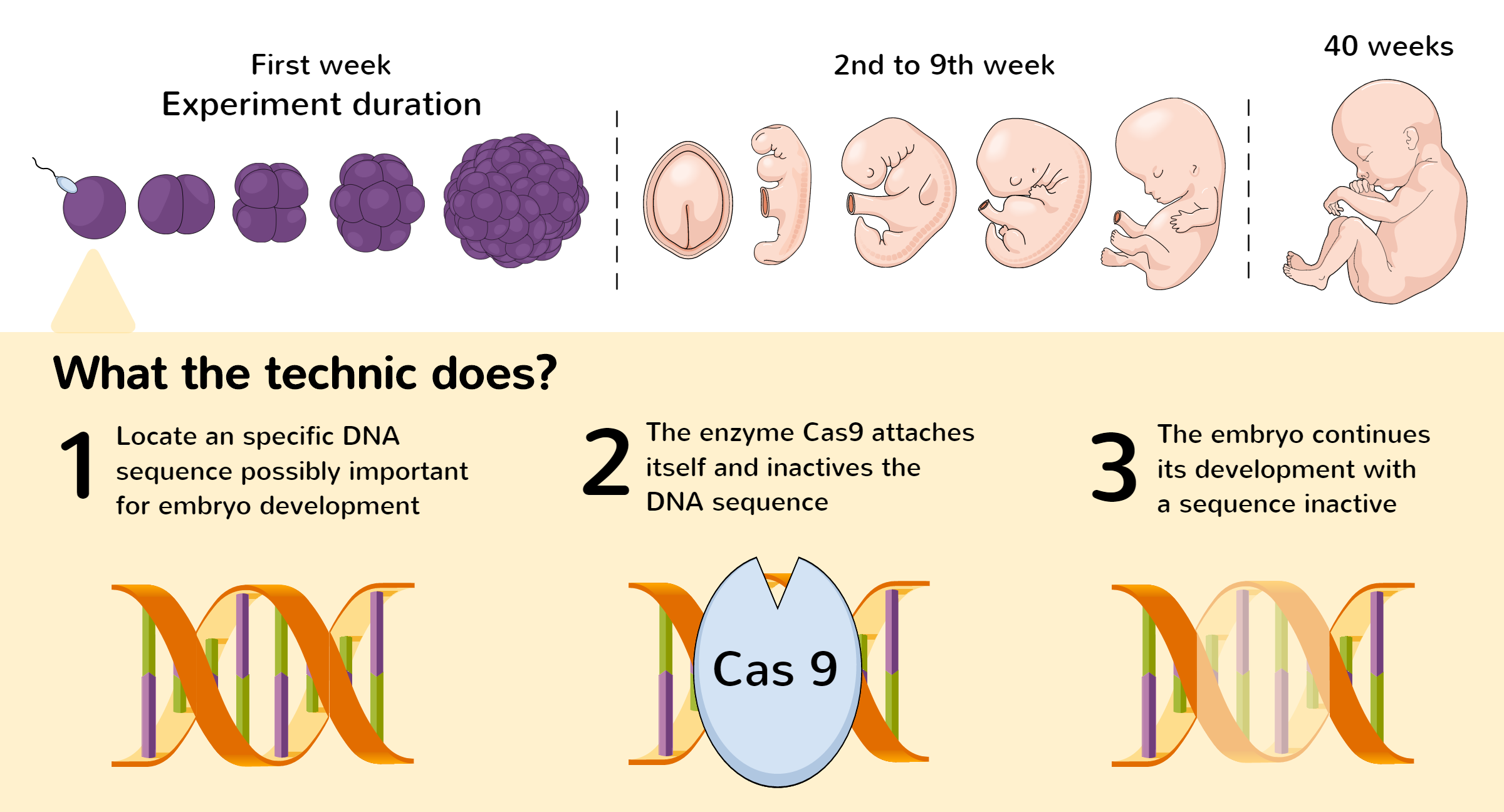
CRISPR-teknikken i laboratoriet omfatter to nøglefigurer: et guide-RNA og et DNA-klippende enzym, oftest Cas9.
For at bruge den genetiske CRISPR-saks til at ændre et genom, skal den DNA-sekvens, der skal ændres, først lokaliseres. Når den relevante DNA-sekvens er blevet identificeret, skal et enkelt guide-RNA (sgRNA) genkende og forbinde sig til den.
Guide-RNA-sekvensen komplementerer mål-DNA-sekvensen. Det betyder, at guide-RNA'et ideelt set kun vil forbinde sig til mål-DNA-sekvensen og ikke til andre dele af genomet.
Cas9-enzymet (molekylært sakseprotein) kobler sig til RNA'et og fører saksen til det nøjagtige sted i genomet, hvor klippet skal udføres.
Denne reparationsproces kan styres ved at modificere DNA'et på det pågældende sted i genomet. Et gen kan for eksempel elimineres eller opdateres for at reparere eventuelle fejl i dets sekvens.
Afhængigt af hvordan CRISPR-systemet er programmeret, er der tre mulige udfald, når målsekvensen er klippet:
- En mutation i DNA'et introduceres for at hele snittet.
- Enzymer er designet til at lave snit på begge sider af mål-DNA'et for at fjerne mål-DNA'et og forbinde enderne igen.
- Et segment af HDR kan indsættes i genomet ved homolog rekombination.

Hvad er bekymringerne ved CRISPR?
- Det er en udfordring at få CRISPR ind i cellerne. Forskerne opdagede en teknik til at gøre det ved at bruge en virus, der er blevet muteret til at bære gener for guide-RNA og Cas9. Da visse vira kan inficere forskellige typer celler, kan de ende med at ændre f.eks. muskelceller, når hensigten var leverceller.
- CRISPR er netop nu ved at blive testet i mennesker, og forskerne er bekymrede for, hvordan kroppen og immunsystemet kan reagere på virus, der indeholder CRISPR, eller på selve CRISPR-elementerne. Fordi elementerne er ukendte for mennesker, kan immunsystemet angribe og ødelægge CRISPR-redigerede celler.
- CRISPR bryder af og til DNA uden for målgenet, hvilket er kendt som "off-target"-klipning. Forskere er bekymrede for, at sådanne utilsigtede ændringer kan være for skadelige og endda kræftfremkaldende.
- Et andet vigtigt spørgsmål er, at modificering af celler i kroppen utilsigtet kan ændre sæd- eller ægceller, som kan gå i arv til fremtidige generationer.
Etiske spørgsmål
CRISPR-behandling giver også anledning til etiske bekymringer. Se nogle af de etiske bekymringer nedenfor:
- Som tidligere nævnt kan ændringer af celler i kroppen fejlagtigt påvirke sæd- eller ægceller, som kan gå i arv til fremtidige generationer. I stedet for at helbrede sygdomme kan disse ændringer hypotetisk bruges til at forbedre ønskværdige egenskaber.
- Mange mennesker er moralsk og religiøst imod brugen af menneskelige embryoner i forskning. Generelt kan embryoforskning involvere levedygtige eller ikke-levedygtige embryoner, der er tilovers efter IVF, eller embryoner, der er skabt specifikt til undersøgelsen. Hvert tilfælde har sit eget unikke sæt af etiske bekymringer.
- Der er bekymring for, at genomredigering vil blive begrænset til de rige, hvilket vil forværre de eksisterende forskelle i adgang til sundhedspleje og andre behandlinger.
Spild ikke tiden! En platform, der er nem at bruge, og som stort set alle kan bruge.
Brug et brugervenligt værktøj til at skabe fantastiske infografikker, illustrationer eller endda forvandle dit arbejde til en flot og forståelig plakat. Pas på grafen er det rette værktøj for dig; du kan bruge skabeloner eller endda anmode om en, der passer til dit job, præcis som du forestillede dig!

Tilmeld dig vores nyhedsbrev
Eksklusivt indhold af høj kvalitet om effektiv visuel
kommunikation inden for videnskab.