Vēzis jau sen ir sarežģīta un daudzveidīga slimība, ko izraisa izmaiņas indivīda DNS, kas aktivizē onkogēnus, vienlaikus inaktivējot audzēja supresorus un izraisot arī epigenoma, kas atbild par normālas gēnu ekspresijas koordināciju, disregulāciju.
Rezumējot var teikt, ka vēzis ir šūnu slimība, kas izraisa izmaiņas vielmaiņā un šūnu struktūrā, izraisot šo šūnu bojājumus līdz tādam līmenim, ka tās vairs nedarbojas pareizi un izvairās no saimnieka aizsardzības mehānismiem.
Daudzi eksperti un profesionāļi savu karjeru velta vēža izpētei, lai pilnībā izprastu visas tā sarežģītības un neskaidrības. Izpētīt, kā mainās genoms, kā šūna pielāgojas un kā notiek slimības sākšanās, ir viens no izšķirošajiem faktoriem, lai izstrādātu efektīvākas ārstēšanas iespējas un uzlabotu vēža pacientu ārstēšanas rezultātus.
CRISPR terapija ir nostiprinājusies kā metode šūnu funkciju izpētei, un tai ir bijusi būtiska ietekme uz vēža pētniecību, sniedzot jaunus atklājumus, kas varētu paātrināt diagnostiku un ārstēšanu.
Kas ir CRISPR terapija?
Kopš zinātnieki atklāja, ka izmaiņas DNS izraisa vēzi, viņi ir meklējuši veidu, kā šīs izmaiņas novērst, izmantojot DNS manipulācijas. Un viena no atrastajām metodēm ir CRISPR terapija.
Ar CRISPR apstrādi var rediģēt cilvēka šūnu DNS tādā pašā veidā, kā to spēj ārkārtīgi precīzas un viegli lietojamas šķēres. CRISPR rediģē gēnus, rūpīgi nogriežot DNS un pēc tam sistemātiski ļaujot DNS laboties.

Kā darbojas CRISPR terapija?
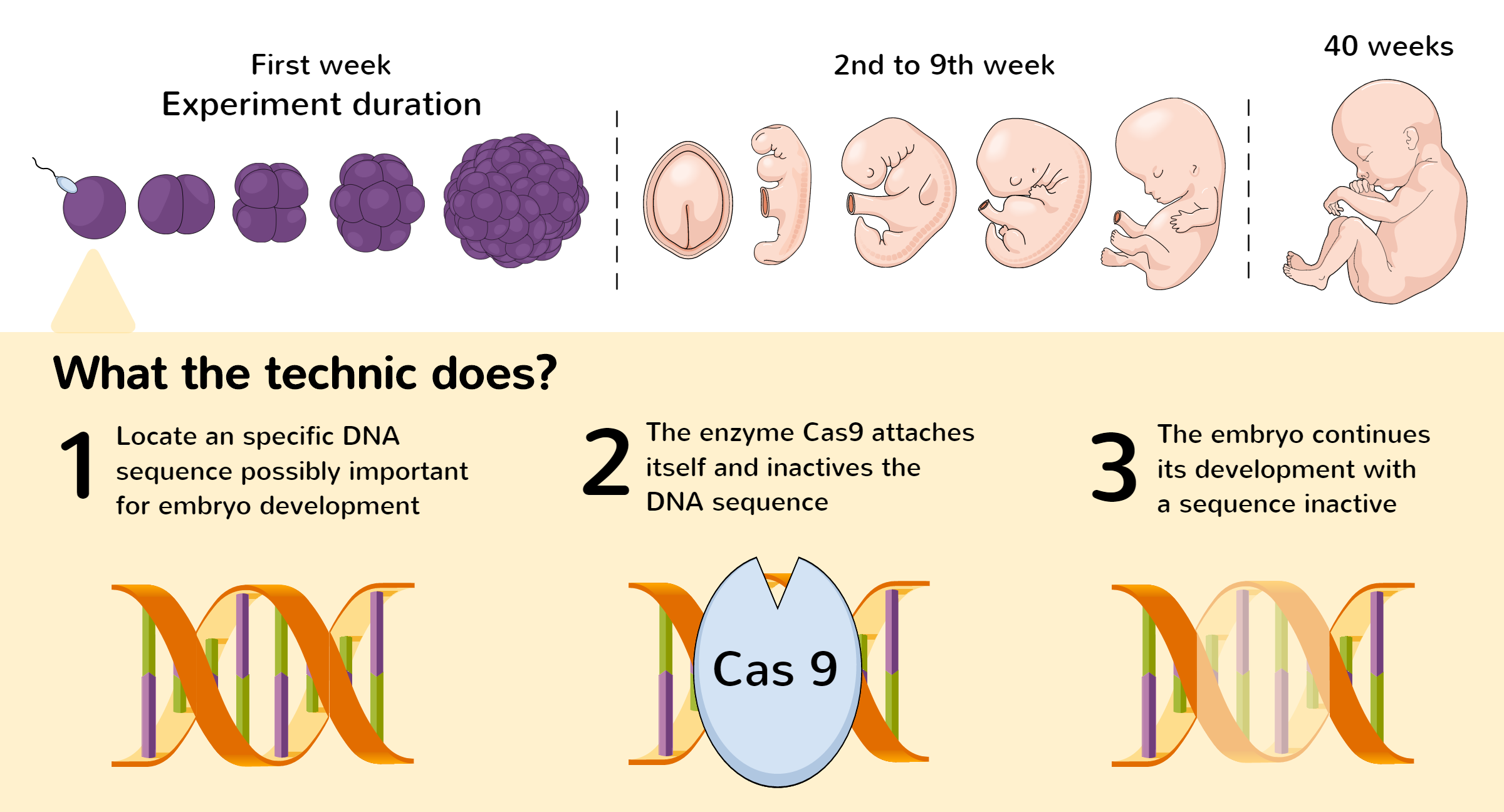
CRISPR tehnika laboratorijā ietver divus galvenos elementus: vadošo RNS un DNS griešanas fermentu, visbiežāk Cas9.
Lai ar CRISPR ģenētiskajām šķērēm mainītu genomu, vispirms ir jāatrod maināmā DNS sekvence. Kad attiecīgā DNS sekvence ir identificēta, to atpazīt un savienot ar to ir paredzēts ar vienu vadošo RNS (sgRNA).
Vadošās RNS sekvence papildina mērķa DNS sekvenci. Tas nozīmē, ka ideālā gadījumā vadošā RNS savienojas tikai ar mērķa DNS sekvenci un nesavienojas ar citām genoma daļām.
Cas9 enzīms (molekulāro šķēru proteīns) savienojas ar RNS un novirza šķēres uz precīzu vietu genomā, kur nepieciešams veikt griezumu.
Šo labošanas procesu var pārvaldīt, lai modificētu DNS šajā genoma vietā. Piemēram, gēnu var likvidēt vai atjaunināt, lai labotu kļūdas tā secībā.
Atkarībā no tā, kā CRISPR sistēma ir ieprogrammēta, pēc mērķa sekvences izgriešanas ir trīs iespējamie rezultāti:
- Lai dziedētu griezumu, DNS tiek ieviesta mutācija.
- Enzīmi ir izstrādāti tā, lai radītu griezumus mērķa DNS abās pusēs, lai noņemtu mērķa DNS un savienotu galus.
- HDR segmentu var ievietot genomā ar homologās rekombinācijas palīdzību.

Kādas ir CRISPR bažas?
- CRISPR ievietošana šūnās ir izaicinājums. Zinātnieki atklāja paņēmienu, kā to izdarīt, izmantojot vīrusu, kas ir mutēts, lai tajā būtu vadošās RNS un Cas9 gēni. Tā kā daži vīrusi var inficēt dažāda veida šūnas, tie var izmainīt, piemēram, muskuļu šūnas, lai gan sākotnējais nolūks bija aknu šūnas.
- CRISPR tikai tagad tiek izmēģināts ar cilvēkiem, un zinātnieki ir nobažījušies par to, kā organisms un imūnsistēma var reaģēt uz vīrusiem, kas ietver CRISPR, vai uz pašiem CRISPR elementiem. Tā kā šie elementi cilvēkiem nav pazīstami, imūnsistēma var uzbrukt un iznīcināt CRISPR rediģētās šūnas.
- CRISPR reizēm pārtrauc DNS ārpus mērķa gēna, ko dēvē par griešanu ārpus mērķa. Zinātnieki ir nobažījušies, ka šādas netīšas izmaiņas var būt pārāk kaitīgas un pat vēža izraisošas.
- Vēl viens svarīgs jautājums ir tas, ka, modificējot ķermeņa šūnas, var netīši izmainīt spermas vai olšūnas, kas var tikt nodotas nākamajām paaudzēm.
Ētikas jautājumi
CRISPR ārstēšana rada arī ētiskas bažas. Tālāk skatīt dažas no ētiskajām problēmām:
- Kā jau iepriekš minēts, mainoties ķermeņa šūnām, var tikt kļūdaini ietekmētas spermas vai olšūnas, kas var tikt nodotas nākamajām paaudzēm. Tā vietā, lai ārstētu slimības, šīs izmaiņas hipotētiski var izmantot, lai uzlabotu vēlamās īpašības.
- Daudzi cilvēki ir pret cilvēka embriju izmantošanu pētniecībā no morāles un reliģijas viedokļa. Kopumā embriju pētījumos var izmantot dzīvotspējīgus vai dzīvotnespējīgus embrijus, kas palikuši pēc mākslīgās apaugļošanas, vai embrijus, kas radīti speciāli pētījumam. Katram šādam gadījumam ir savs ētikas apsvērumu kopums.
- Pastāv bažas, ka genoma rediģēšana būs pieejama tikai bagātajiem, tādējādi saasinot pastāvošās atšķirības veselības aprūpes, kā arī citu ārstēšanas veidu pieejamībā.
Netērējiet laiku! Platforma ir viegli lietojama, un to var izmantot gandrīz ikviens.
Izmantojiet viegli lietojamu rīku, lai radītu satriecošas infografikas, ilustrācijas vai pat pārveidotu savu darbu krāšņā un saprotamā plakātā. Atcerieties grafiku ir jums piemērots rīks; varat izmantot veidnes vai pat pieprasīt tādu, kas precīzi atbilst jūsu darbam, kā jūs to iedomājāties!

Abonēt mūsu biļetenu
Ekskluzīvs augstas kvalitātes saturs par efektīvu vizuālo
komunikācija zinātnē.