Yli puolet dementiatapauksista luokitellaan nykyään Alzheimerin taudiksi - krooniseksi hermoston rappeutumissairaudeksi, joka vaikuttaa vähitellen ihmisen kognitioon ja muistiin.
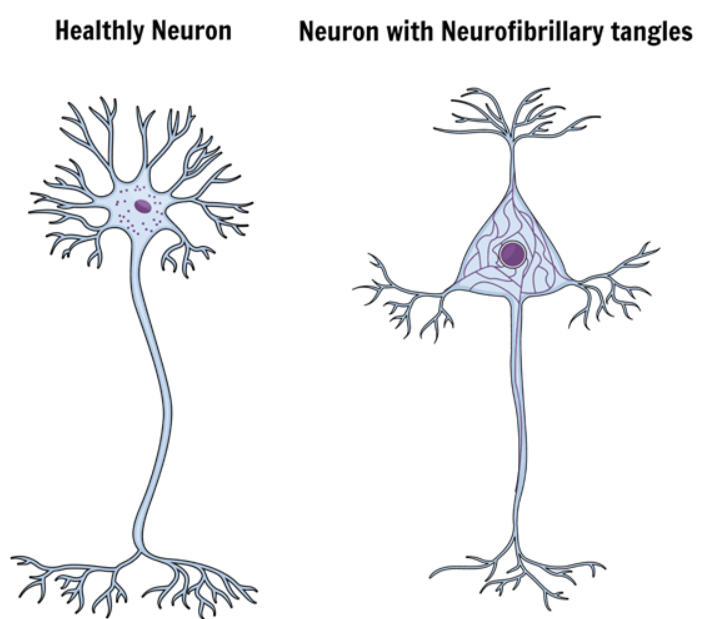
Tähän päivään asti sen uskottiin johtuvan geneettisistä ja ikääntymiseen liittyvistä tekijöistä, ja sairauden pahiksiksi ja keskeisiksi syyllisiksi katsotaan seniili plakit ja neurofibrillaarinen sekasikiö, jotka johtavat neuroinflammaatioon ja järjestyksessä hermosolujen kuolemaan.
Uusi teoria Alzheimerin taudin syistä valottaa kuitenkin lääketieteellisen tutkimuksen taivaalle.
Teorian mukaan genetiikka ja ikääntyminen eivät ole ainoita tekijöitä, jotka ovat vastuussa amyloidikertymien - proteiinin, joka kerääntyy hermosolujen väliin aiheuttaen Alzheimerin taudin - muodostumisesta, vaan se voi olla myös laukaiseva reaktio mikrobitartuntaan.
Katsotaanpa tarkemmin neurologista asteikkoa, jotta ymmärretään, mitä Alzheimerin tautia sairastavan aivoissa tapahtuu. Tapahtumassa on kaksi merkittävää ilmiötä.
Tau-niminen proteiini vastaa vakauden ylläpitämisestä tukemalla mikrotubuluksia neuronien sisällä. Tautia sairastavissa aivoissa tau muuttuu biokemiallisesti hyperfosforylaattireaktioksi kutsutulla reaktiolla.
Tämän muutoksen seurauksena hermosolun sisällä on liukenemattomia proteiinikappaleita, jotka hajottavat koko järjestelmän ja tappavat hermosoluja.
Nämä liukenemattomat tau-proteiinien kappaleet kasautuvat toisiinsa muodostaen neurofibrillaariset tangelit.
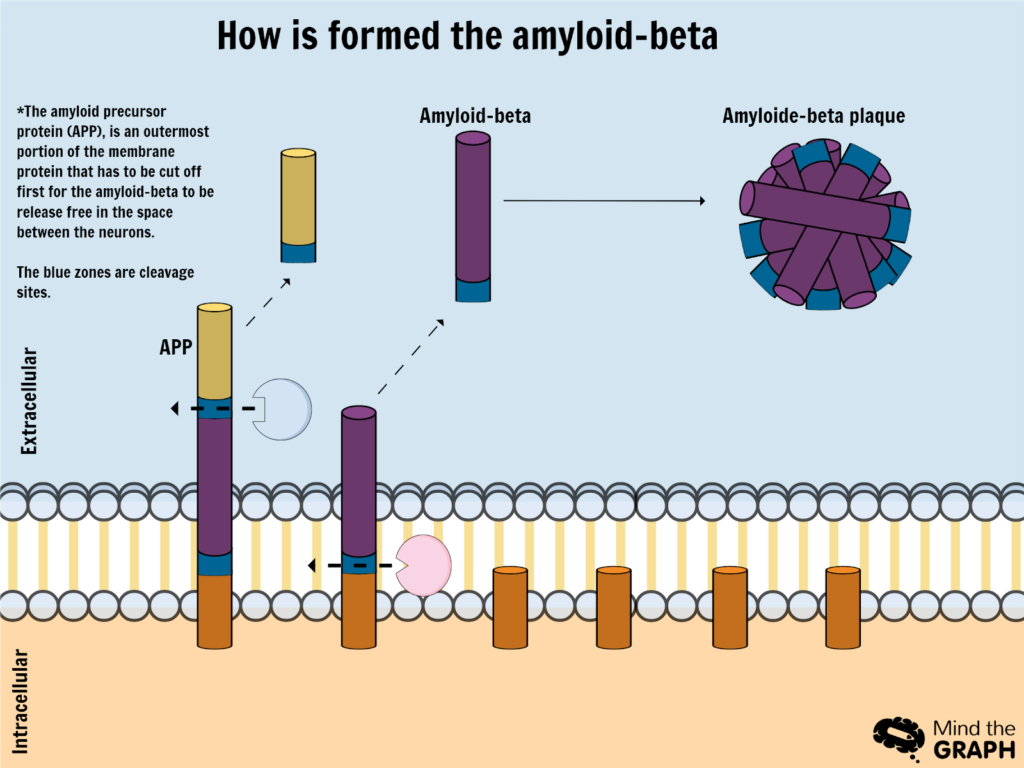
The seniiliplakit on valmistettu amyloidi-β-peptidit. Neuronien kalvoissa oleva proteiini (pre-amyloidi) pilkkoutuu, jolloin vapaat amyloidi-β-kappaleet jäävät neuronien ulkopuolelle*.
Näiden kappaleiden pitäisi oletettavasti puhdistua neuronien ulommasta väliaineesta erityisten solujen ja entsyymien fagosytoosin avulla, mutta geneettisten tai ikääntymiseen liittyvien tekijöiden vuoksi tämä prosessi ei tapahdu riittävän tehokkaasti, mikä johtaa liukenemattomien amyloidi-β-proteiinien vapaisiin kappaleisiin, jotka alkavat kasautua plakkeihin.
Amyloidiplakkeja on tutkittu ja keskusteltu eniten Alzheimerin taudin aiheuttajina. Tutkijat vahvistavat kuitenkin myös, että neurofibrillaariset tangelit liittyvät suoraan taudin etenemiseen.
Tutkijat löysivät amyloidiryhmiä myös terveistä pos-mortem-aivoista. Tämä tarkoittaa, että myös terveissä vanhoissa aivoissa puhdistusprosessi heikkenee, mutta ei niin paljon kuin Alzheimerin tautia sairastavissa aivoissa.
Siksi Alzheimerin taudille on ominaista suuri määrä näitä seniiliplakkeja ja neurofibrillaarisia tangleja, joista tulee erittäin myrkyllisiä aivoille ja jotka muuttavat synapsien tehokkuutta ja laatua.
Sairastuneilla on oireita, kuten muistin menetys, ajan ja paikan sekavuus, masennus, ahdistuneisuus, kieli- ja kommunikaatio-ongelmat, mielialan epävakaus ja muut.
Uudessa ehdotetussa teoriassaamyloidiplakit ovat aivojen suojamekanismi mikrobien tartunnalta.
Amyloidi-β-geeni esiintyy suuressa osassa selkärankaisten ryhmää, ja se on säilynyt eri lajeissa useiden sukupolvien ajan, mikä tarkoittaa, että sillä pitäisi olla hyödyllinen ja tärkeä tehtävä elimistössämme, eikä se toimisi vain haitallisena - jos se ei olisi jotain pätevää tai hyödyllistä, geeni olisi kadonnut jo kauan sitten evoluution tieltä.
Tutkijat etsivät tuhansia kuolemanjälkeisiä aivoja Alzheimerin tautia sairastavilta ihmisiltä.
Vaikka he kohtasivat vaikeuksia näiden aivojen analysoinnissa huonojen olosuhteiden vuoksi, he pystyivät tutkimaan ja keräämään tietoja, joiden perusteella he pystyivät myöhemmin ehdottamaan muutamia mahdollisia mikrobien laukaisevia tekijöitä.
Nämä laukaisijat ovat puolustusmekanismeja joitakin ihmisen herpesvirustyyppejä, kuten herpesvirus 1, 6A ja 7, sekä kolmea bakteeria vastaan, Klamydia keuhkokuume, Borrelia burgdorferi, Porphyromonas gingivalis.
Teorian mukaan beeta-amyloidilla on alun perin puolustautumistehtävä, sillä se vangitsee aivoja kohti liikkuvat mikrobit ja pysäyttää mahdollisen infektion tai sairauden.
Kuten mainittiin, ikääntymistekijöiden vuoksi aivot menettävät kykynsä puhdistaa amyloideja tehokkaasti. Näin ollen käsitys amyloidin toiminnasta voi olla koko ajan väärä; se osallistuu todennäköisesti eräänlaiseen antimikrobiseen suojautumiseen aivojen tunkeutujia vastaan, sillä se luokitellaan antimikrobiseksi peptidiksi.
Tutkijat ovat saaneet myönteisiä tuloksia, kun he ovat yrittäneet osoittaa, että β-amyloidi voi tappaa mikro-organismeja, jotka ovat peräisin muutamista yleisistä sairauksista.
Lisäksi toisessa tutkimuksessa, joka alkoi vuonna 2007 ja jonka on tarkoitus päättyä vuonna 2022 New Yorkissa sijaitsevassa Columbian yliopistossa, testataan viruslääkettä potilailla, joilla on herpes simplex -virus 1 ja lievä Alzheimerin tauti, jotta nähdään, voiko lääke hidastaa taudin etenemistä.
Toistaiseksi voimme vain toivoa parasta ja odottaa tuloksia.
Koko tiedeyhteisö ei ole vieläkään hyväksynyt tätä uutta teoriaehdotusta. Monet tiedemiehet väittävät, että vaikka tämä uusi teoriaehdotus osoittautuisi todeksi, geneettiset tekijät ja huonot mutaatiot ovat edelleen taudin pääsyy.
Alzheimerin tauti on sairaus, jonka todellisista syistä on edelleen hyvin vähän tieteellistä tietoa; siihen ei ole olemassa parannuskeinoa eikä monia terapeuttisia hoitovaihtoehtoja. Jos tämä teoria osoittautuu todeksi, se voisi olla ensimmäinen askel kohti parempia hoitomuotoja. Hyvä tiede!
Viitteet
ABBOTT, A. Kylvävätkö infektiot joitakin Alzheimerin taudin tapauksia? Luonto, v. 587, n. 7832, s. 22-25, 4.11.2020.
CECÍ, K. et al. Biomarkers in Alzheimer disease. Geriatria, gerontologia ja ikääntyminen, v. 6, n. 3, s. 273-282, 2012.
MAKIN, S. Amyloidihypoteesi oikeudenkäynnissä. Luonto, v. 559, n. 7715, s. S4-S7, 25. heinäkuuta 2018.
YOO, K.-Y.; PARK, S.-Y. Terpenoidit potentiaalisina Alzheimerin taudin hoitoaineina. Molekyylit, v. 17, n. 3, s. 3524-3538, maaliskuu. 2012.
___
Jos haluat luoda infograafin tieteellisiin tarkoituksiin - kuten minä - Mind the Graph:ssä voit luoda minkälaisen infograafin tahansa. Alusta on täällä, jotta tiedemiehistä tulisi suunnittelijoita, jotka voivat lisätä vaikuttavuuttaan! Liity meihin alustalla, klikkaa tästä!

Tilaa uutiskirjeemme
Eksklusiivista korkealaatuista sisältöä tehokkaasta visuaalisesta
tiedeviestintä.