En stor del af en forskers rutine er at designe og udføre eksperimenter.
Kombinationen af laboratorieteknikker vil besvare de fleste af de spørgsmål, som forskerne stiller, og arbejdsgangen med at foreslå nye metoder afhænger af forskerens baggrund og erfaring.
For biologer kan cellebilleder sige meget om, hvad der foregår i de processer og mekanismer, de studerer.
Lysmikroskopi er en meget udbredt teknik inden for biologiske videnskaber.
Brugen af farvestoffer, antistoffer og fluorescerende prober gør det muligt for forskere at se billeder i mikroskopcellerne af det, der ellers var for småt til at blive set og endda forstået.
Fluorescens-mikroskoper og brugen af fluorokromer blev muligt i 19301og i dag er det muligt at anvende mange kombinationer af fluorokromer til farvning af proteiner, organeller og strukturer i celler og væv.
Fluorokromer (eller fluoroforer) er molekyler, der, når de exciteres med en bestemt bølgelængde af lys, udsender lys med en defineret bølgelængde, som indfanges af linserne i et mikroskop og omdannes til et faktisk billede.
Kombinationen af fluorescens, linser og kameraer gør det muligt for os at tage et billede af processer inde i celler fra mange forskellige vinkler og aspekter.
Ved hjælp af mikroskopet har vi for eksempel et bredere overblik over en skive af en musehjerne i et 2,5x eller 4x objektiv, og små detaljer om det undersøgte aktincytoskelet i den samme prøve ved hjælp af et 63x objektiv.
For at muliggøre disse assays kan vi bruge antistoffer eller farvestoffer mod specifikke proteiner, der findes i cellen eller vævet, og antistoffet leveres normalt med en fluorofor.
Stokes' skift forklarer dette fænomen: Fluoroforer mister vibrationsenergi i form af udsendt lys, når de skifter fra en exciteret tilstand tilbage til grundtilstanden. Fluorescensmikroskoper leverer lyset til at excitere fluoroforen og modtager dens udsendte lys. Det udsendte lys kan opfanges af en linse, behandles i et CCD-kamera og omdannes til et digitalt billede.
Men lad os tale om optagelse af cellebilleder senere. Nu skal vi præsentere dig for eksempler og tips til de vigtigste trin, før du optager dit billede.
Hvordan vælger og kombinerer vi forskellige typer farvestoffer og antistoffer for at se og forstå forholdet mellem organeller og proteiner inde i celler eller væv?
Først skal forskerne afgøre, hvilke antistoffer og farvestoffer de skal bruge baseret på deres forskning.
For eksempel, i denne artikelforsøgte Mendonça at evaluere virkningerne og de potentielle risici ved kationiske faste lipidnanopartikler (cSLN) i rotter. Mange nanopartikler udvikles og undersøges hvert år med det formål at forbedre leveringen af lægemidler eller gener til behandling af mange sygdomme. Et af de interessante spørgsmål i denne undersøgelse var, om nanopartiklerne var i stand til at nå hjernen ved at krydse blod-hjerne-barrieren. Denne barriere beskytter vores hjerne mod cirkulerende toksiner eller patogener, og normalt er det ikke ønskeligt, at molekyler krydser barrieren. Men i dette særlige tilfælde, Mendonça's Målet var, at nanopartiklerne skulle krydse barrieren og nå hjernen, så de kunne levere lægemidler eller gener i en fremtidig anvendelse.
For at se, om nanopartiklerne var til stede i hjernens parenkym, brugte forfatterne en endotelcellemarkør for karrene kaldet RECA-1 (repræsenteret i rødt), mens cellekernerne blev farvet med et farvestof kaldet DAPI (4′,6-diamidino-2-phenylindol), som er blåt. Vi kan også se små grønne prikker for nanopartiklerne uden for karrene, hvilket betyder, at de nåede ind i hjernens parenkym.
Se infografikken nedenfor med et repræsentationsbillede.
Lad os forstå, hvad antistoffet mod RECA-1 (rød) gør.
Disse antistoffer er designet til at fungere som specifikke prober, og de er rettet mod et specifikt antigen (i vores tilfælde proteinet RECA-1).
De kan mærkes med en fluorofor eller genkendes senere af et sekundært antistof, der er forbundet med en fluorofor.
Derfor skal prøven aktiveres med en lyskilde, Det specifikke protein, du leder efter, vil blive genkendt i din prøve ved udsendelse af lys i en bestemt bølgelængde..
I tilfældet med DAPI er dette farvestof modfarvning af kerner og nukleosomer, og det udsender blå fluorescens, når det bindes til AT-regioner i DNA'et.
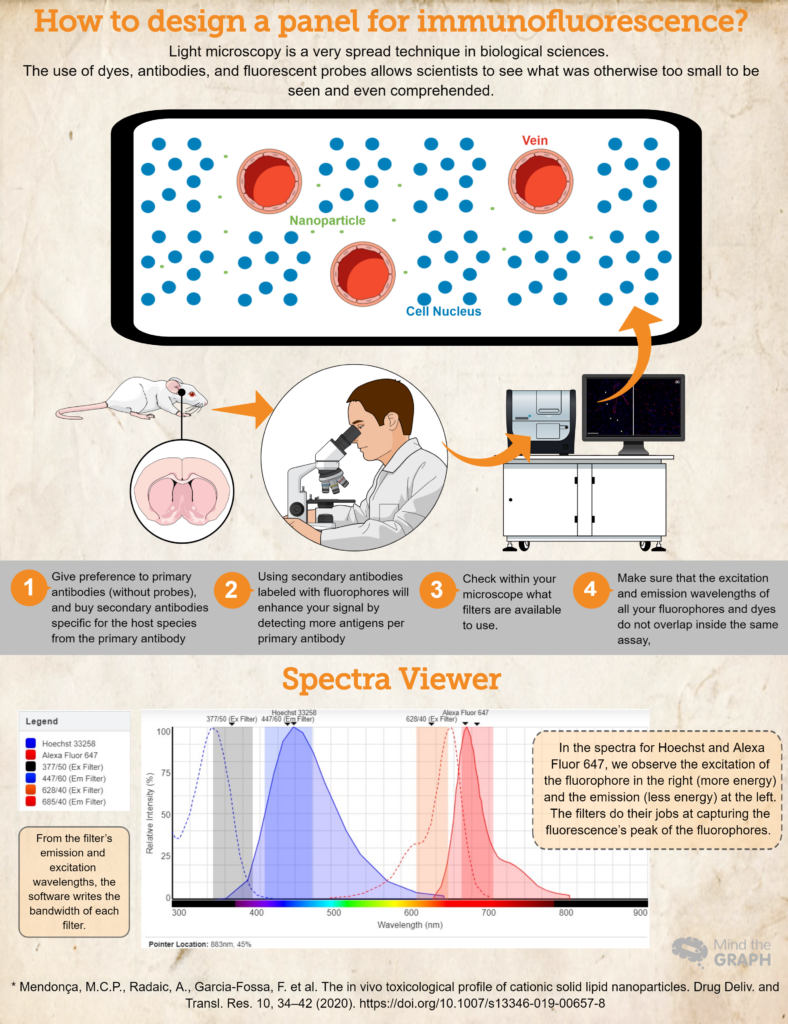
Hvordan designer man et panel til immunofluorescens?
Start med disse trin:
- Køb (eller lån! Videnskab bør være meget samarbejdsvillig!) antistoffer og farvestoffer, der er vigtige for din forskning. Foretrækker primære antistoffer (uden prober), og køb sekundære antistoffer, der er specifikke for værtsarten fra det primære antistof. Hvis du f.eks. bruger et primært antistof produceret i kaniner, skal du bruge et sekundært antistof til anti-kanin. Dette vil garantere specificitet.
- Brug af sekundære antistoffer mærket med fluoroforer vil forbedre dit signal ved at detektere flere antigener pr. primært antistof. Det er også en mere dynamisk måde at udarbejde forskellige assays på, fordi det giver forskeren mulighed for at ændre farverne i panelet baseret på hendes behov.
- Et andet vigtigt skridt er at tjekke, hvilke filtre der er tilgængelige i mikroskopet. Du skal sikre dig, at dine fluoroforers excitations- og emissionsbølgelængder ligger inden for excitations- og emissionsfiltrene; ellers vil du ikke være i stand til at fange emissionslyset fra dine prober. Du kan bruge Visning af fluorescensspektre for at tjekke kompatibiliteten.
- For at sikre, at excitations- og emissionsbølgelængderne for alle dine fluoroforer og farvestoffer ikke overlapper hinanden i det samme assay, Visning af fluorescensspektre er et godt valg. De dækker næsten alle de tilgængelige fluoroforer!
Til sidst kan du se et eksempel på et hypotetisk eksperiment, hvor vi har Hoechst 33258 til nukleinsyrerne og et primært antistof mod RECA-1 mærket med et sekundært antistof Alexa Fluor 647.
Ideelt set ville vi bruge et mikroskop med en DAPI-kube (excitation 377/50 og emission 447/60) og en CY5-kube (excitation 628/40 og emission 685/40). Alle disse oplysninger har vi indsat på Visning af fluorescensspektre og fik spektrene for begge farvestoffer og båndbredderne for begge kuber (se spektret i infografikken ovenfor).
Dette hypotetiske essay er et godt eksempel på, at fluoroforernes spektre hører til inden for excitations- og emissionsfiltrene, hvilket gør det muligt for forskeren at indfange sine prøver på den bedst mulige måde.
Nu er det tid til at gå i laboratoriet og omsætte det hele til praksis!
Jeg håber, at disse tips kan hjælpe dig med dit næste laboratorieforsøg. Held og lykke med det!
Referencer:
- Introduktion til fluorescensmikroskopi. Nikons mikroskopiU https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Tilgået 2021-04-11 17:20:40.

Tilmeld dig vores nyhedsbrev
Eksklusivt indhold af høj kvalitet om effektiv visuel
kommunikation inden for videnskab.