En stor del av en forskares vardag består av att utforma och utföra experiment.
Kombinationen av laboratorietekniker kommer att besvara de flesta av de frågor som ställs av forskare, och arbetsflödet för att föreslå nya metoder beror på forskarens bakgrund och erfarenhet.
För biologer kan cellbilder säga mycket om vad som händer med de processer och mekanismer som de studerar.
Ljusmikroskopi är en mycket utbredd teknik inom biologiska vetenskaper.
Med hjälp av färgämnen, antikroppar och fluorescerande prober kan forskarna i mikroskopcellerna se bilder av det som annars var för litet för att kunna ses eller ens uppfattas.
Fluorescensmikroskop och användning av fluorokromer blev möjligt 19301och idag kan man använda många olika kombinationer av fluorokromer för att färga proteiner, organeller och strukturer i celler och vävnader.
Fluorokromer (eller fluoroforer) är molekyler som när de exciteras med en specifik våglängd avger ljus med en definierad våglängd som fångas upp av linserna i ett mikroskop och omvandlas till en faktisk bild.
Kombinationen av fluorescens, linser och kameror gör att vi kan ta en bild av processer inuti celler ur många olika synvinklar och aspekter.
Med ett mikroskop kan vi t.ex. få en bredare bild av en mushjärna i ett 2,5x eller 4x objektiv, och små detaljer av det undersökta aktincytoskelettet i samma prov med ett 63x objektiv.
För att möjliggöra dessa analyser kan vi använda antikroppar eller färgämnen mot specifika proteiner som finns i cellen eller vävnaden, och antikroppen har vanligtvis en fluorofor.
Stokes skift förklarar detta fenomen: fluoroforer förlorar vibrationsenergi i form av utsänt ljus när de går från ett exciterat tillstånd tillbaka till grundtillståndet. Fluorescensmikroskop ger ljus för att excitera fluoroforen och tar emot dess utsända ljus. Det utsända ljuset kan fångas upp av en lins, bearbetas i en CCD-kamera och omvandlas till en digital bild.
Men låt oss prata om cellbildstagning senare. Nu ska vi presentera exempel och tips för de viktigaste stegen innan du tar din bild.
Hur väljer och kombinerar vi olika typer av färgämnen och antikroppar för att se och förstå sambanden mellan organeller och proteiner i celler eller vävnader?
Först måste forskarna bestämma vilka antikroppar och färgämnen som ska användas baserat på deras forskning.
Till exempel, i denna artikelförsökte Mendonça utvärdera effekterna och de potentiella riskerna med katjoniska fasta lipidnanopartiklar (cSLN) i råttor. Många nanopartiklar utvecklas och studeras varje år, i syfte att förbättra leveransen av läkemedel eller gener för att behandla många sjukdomar. En av de intressanta frågorna i den här studien var om nanopartiklarna kunde nå hjärnan genom att passera blod-hjärnbarriären. Denna barriär skyddar vår hjärna från cirkulerande toxiner eller patogener, och vanligtvis är det inte önskvärt att molekyler korsar barriären. Men i detta speciella fall, Mendonças Målet var att nanopartiklarna skulle passera barriären och nå hjärnan, för att i en framtida tillämpning kunna leverera läkemedel eller gener.
För att se om nanopartiklarna fanns i hjärnparenkymet använde författarna en endotelcellsmarkör för kärlen som heter RECA-1 (visas i rött), medan cellkärnorna färgades med ett färgämne som heter DAPI (4′,6-diamidino-2-phenylindole) som är blått. Vi kan också observera små gröna prickar för nanopartiklarna utanför kärlen, vilket innebär att de nådde hjärnparenkym.
Kolla in infografiken nedan med en representativ bild.
Låt oss förstå vad antikroppen för RECA-1 (röd) gör.
Dessa antikroppar är utformade för att fungera som specifika prober, och de riktar in sig på en specifik antigen (i vårt fall proteinet RECA-1).
De kan märkas med en fluorofor eller senare kännas igen av en sekundär antikropp som är kopplad till en fluorofor.
Efter att provet har aktiverats med en ljuskälla, det specifika protein du letar efter kommer att kännas igen i ditt prov genom emission av ljus i en specifik våglängd.
När det gäller DAPI är detta färgämne motfärgning av kärnor och nukleosomer, och det avger blå fluorescens när det binds till AT-regioner i DNA.
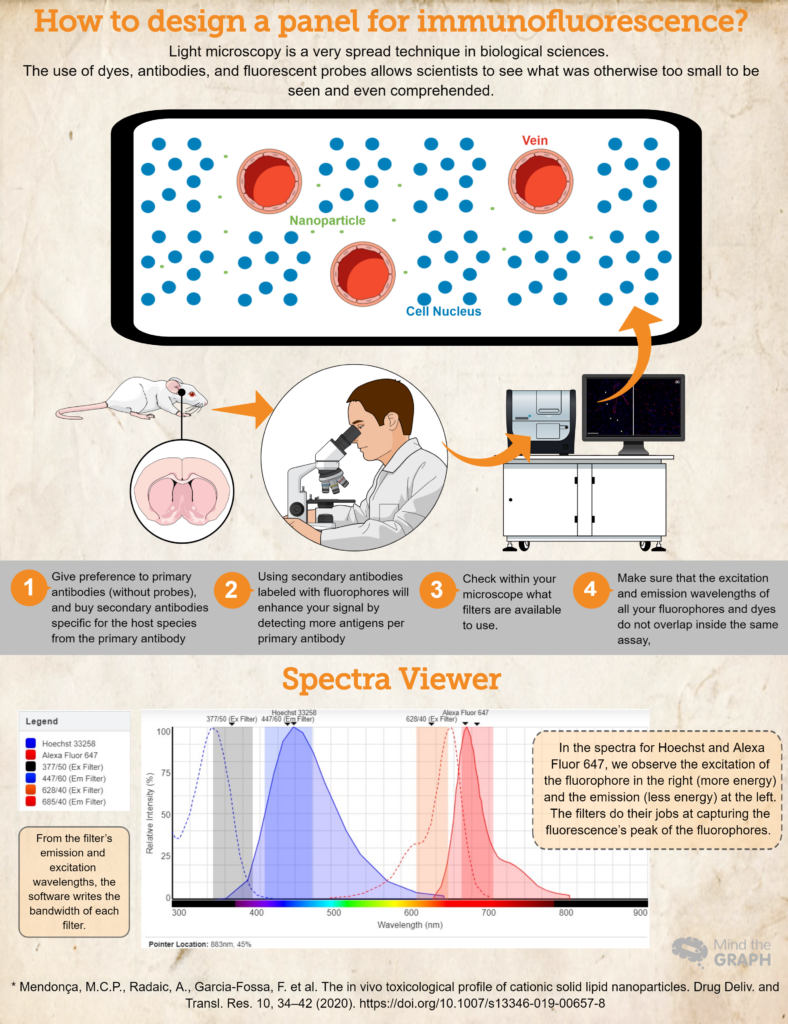
Hur utformar man en panel för immunofluorescens?
Börja med dessa steg:
- Köp (eller låna! Vetenskap bör vara mycket samarbetsinriktad!) antikroppar och färgämnen som är nödvändiga för din forskning. Föredra primära antikroppar (utan prober) och köp sekundära antikroppar som är specifika för värdarten från den primära antikroppen. Om du t.ex. använder en primär antikropp som producerats i kaniner ska du använda en sekundär antikropp för anti-kanin. Detta garanterar specificitet.
- Om sekundära antikroppar märkta med fluoroforer används förstärks signalen genom att fler antigener detekteras per primär antikropp. Detta är också ett mer dynamiskt sätt att utveckla olika assays, eftersom forskaren kan modifiera färgerna i panelen utifrån sina behov.
- Ett annat viktigt steg är att kontrollera vilka filter som finns tillgängliga i mikroskopet. Du bör se till att våglängderna för excitation och emission för din fluorofor ligger inom excitations- och emissionsfiltren, annars kommer du inte att kunna fånga upp emissionsljuset från dina prober. Du kan använda Visare för fluorescensspektra för att kontrollera kompatibiliteten.
- Se till att excitations- och emissionsvåglängderna för alla dina fluoroforer och färgämnen inte överlappar varandra i samma analys, Visare för fluorescensspektra är ett utmärkt val. De täcker nästan alla tillgängliga fluoroforer!
Kontrollera slutligen ett exempel på ett hypotetiskt experiment där vi har Hoechst 33258 för nukleinsyrorna och en primär antikropp mot RECA-1 märkt med en sekundär antikropp Alexa Fluor 647.
Helst skulle vi använda ett mikroskop med en DAPI-kub (excitation 377/50 och emission 447/60) och en CY5-kub (excitation 628/40 och emission 685/40). All denna information finns på Visare för fluorescensspektra och fick fram spektrumet för båda färgämnena och bandbredden för båda kuberna (se spektrumet i infografiken ovan).
Denna hypotetiska uppsats är ett bra exempel där fluoroforernas spektra hör hemma i excitations- och emissionsfiltren, vilket gör det möjligt för forskaren att fånga sina prover på bästa möjliga sätt.
Nu är det dags att gå till labbet och omsätta allt i praktiken!
Jag hoppas att dessa tips hjälper dig med ditt nästa labbförsök. Lycka till!
Referenser:
- Introduktion till fluorescensmikroskopi. Nikons mikroskopiU https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Hämtad 2021-04-11 17:20:40.

Prenumerera på vårt nyhetsbrev
Exklusivt innehåll av hög kvalitet om effektiv visuell
kommunikation inom vetenskap.