Большая часть рутины ученого заключается в разработке и проведении экспериментов.
Сочетание лабораторных методов позволит ответить на большинство вопросов, предлагаемых учеными, а умение предложить новые методы зависит от образования и опыта ученого.
Для биологов изображения клеток могут многое рассказать о том, что происходит в изучаемых ими процессах и механизмах.
Световая микроскопия является очень распространенным методом в биологических науках.
Использование красителей, антител и флуоресцентных зондов позволяет ученым увидеть в клетках микроскопа изображения того, что иначе было слишком маленьким, чтобы увидеть и даже постичь.
Флуоресцентные микроскопы и использование флуорохромов стало возможным в 1930 году1Сегодня возможно множество комбинаций флуорохромов для окрашивания белков, органелл и структур внутри клеток и тканей.
Флюорохромы (или флюорофоры) это молекулы, которые при возбуждении светом определенной длины волны испускают свет определенной длины волны, который улавливается объективами микроскопа и преобразуется в реальное изображение.
Сочетание флуоресценции, линз и камер позволяет нам получать изображение процессов внутри клеток в различных ракурсах и аспектах.
Например, используя микроскоп, мы имеем более широкий обзор среза мозга мыши при объективе 2,5x или 4x, и мелкие детали зондируемого актинового цитоскелета в том же образце при объективе 63x.
Для проведения таких анализов мы можем использовать антитела или красители против конкретных белков, присутствующих в клетке или ткани, причем антитело обычно поставляется с флуорофором.
Сдвиг Стокса объясняет это явление: флуорофоры теряют колебательную энергию в виде излучаемого света, когда они переходят из возбужденного состояния обратно в основное. Флуоресцентные микроскопы подают свет для возбуждения флуорофора и получают его излучение. Излучаемый свет может быть захвачен объективом, обработан в CCD-камере и преобразован в цифровое изображение.
Но давайте поговорим о получении изображения клеток позже. Сейчас нам следует познакомить вас с примерами и советами по основным этапам, предшествующим получению изображения.
Как мы выбираем и комбинируем различные типы красителей и антител, чтобы увидеть и понять взаимосвязи между органеллами и белками внутри клеток или тканей?
Во-первых, ученым необходимо определить, какие антитела и красители использовать на основе проведенного ими исследования.
Например, в этой статьеМендонса пытался оценить действие и потенциальные риски катионных твердых липидных наночастиц (cSLNs) на крысах. Ежегодно разрабатывается и изучается множество наночастиц, целью которых является улучшение доставки лекарств или генов для лечения многих заболеваний. Один из интересных вопросов этого исследования заключался в том, смогли ли наночастицы достичь мозга, преодолев гематоэнцефалический барьер. Этот барьер защищает наш мозг от циркулирующих токсинов или патогенов, и обычно нежелательно, чтобы молекулы пересекали барьер. Но в данном конкретном случае, Мендонса Цель заключалась в том, чтобы наночастицы преодолели барьер и достигли мозга для доставки лекарств или генов в будущем.
Желая проверить, присутствуют ли наночастицы в паренхиме мозга, авторы использовали маркер эндотелиальных клеток сосудов под названием RECA-1 (представлен красным цветом), а ядра клеток окрашивали красителем DAPI (4′,6-диамидино-2-фенилиндол), который имеет синий цвет. Мы также можем наблюдать маленькие зеленые точки для наночастиц вне сосудов, что означает, что они достигли паренхимы мозга.
Ознакомьтесь с приведенной ниже инфографикой с изображением репрезентативности.
Давайте разберемся, что делает антитело к RECA-1 (красное).
Эти антитела разработаны в качестве специфических зондов и нацелены на определенный антиген (в нашем случае на белок RECA-1).
Они могут быть помечены флуорофором или распознаны позднее вторичным антителом, связанным с флуорофором.
Поэтому после возбуждения образца источником света, конкретный белок, который вы ищете, будет распознан в вашем образце по излучению света с определенной длиной волны.
В случае DAPI этот краситель является контрастирующим веществом для ядер и нуклеосом, и он излучает синюю флуоресценцию при связывании с AT-областями ДНК.
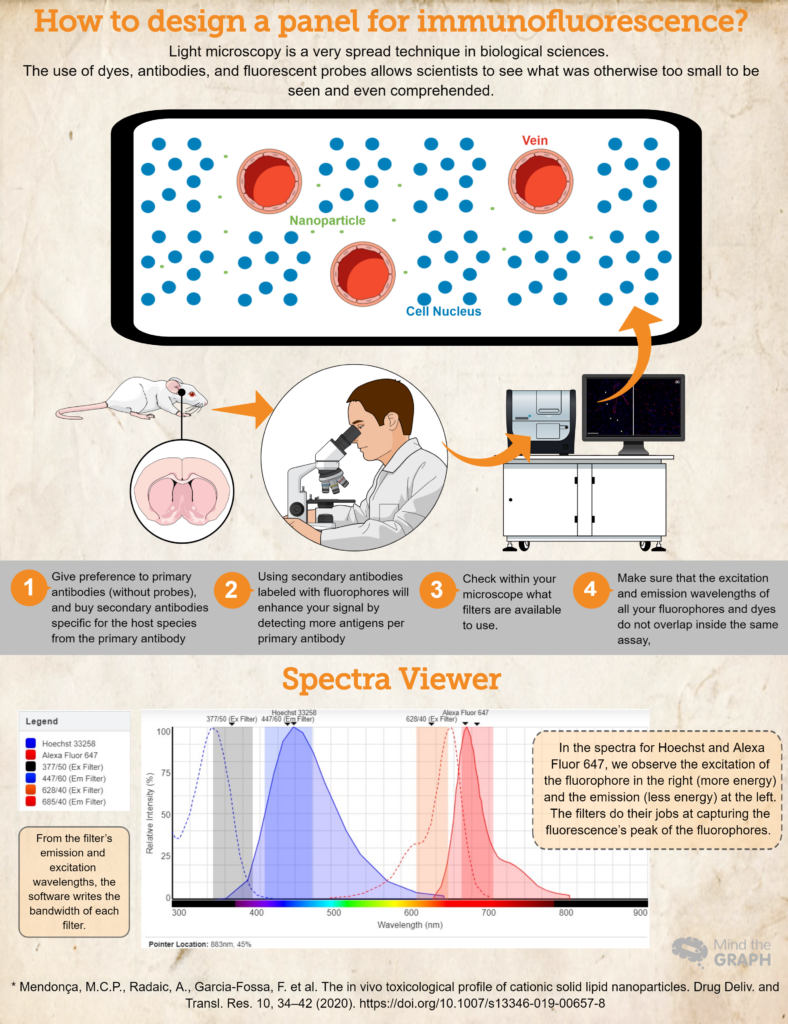
Как разработать панель для иммунофлуоресценции?
Начните с этих шагов:
- Купите (или одолжите! Наука должна быть очень совместной!) антитела и красители, необходимые для вашего исследования. Отдавайте предпочтение первичным антителам (без зондов) и покупайте вторичные антитела, специфичные для вида хозяина первичного антитела. Например, при использовании первичного антитела, полученного на кроликах, используйте вторичное антитело анти-кролик. Это гарантирует специфичность.
- Использование вторичных антител, меченных флуорофорами, усилит сигнал за счет обнаружения большего количества антигенов на одно первичное антитело. Кроме того, это более динамичный способ разработки различных анализов, поскольку он позволяет исследователю изменять цвета в панели в зависимости от своих потребностей.
- Еще один важный шаг - проверить, какие фильтры доступны для использования в вашем микроскопе. Вы должны убедиться, что длины волн возбуждения и эмиссии вашего флуорофора лежат в пределах фильтров возбуждения и эмиссии; в противном случае вы не сможете уловить эмиссионный свет от ваших зондов. Вы можете использовать Программа просмотра спектров флуоресценции чтобы проверить совместимость.
- Чтобы убедиться, что длины волн возбуждения и испускания всех ваших флуорофоров и красителей не перекрываются в одном анализе, Программа просмотра спектров флуоресценции это отличный выбор. Они покрывают почти все доступные флуорофоры!
Наконец, проверьте пример для гипотетического эксперимента, где у нас есть Hoechst 33258 для нуклеиновых кислот и первичное антитело против RECA-1, помеченное вторичным антителом Alexa Fluor 647.
В идеале мы должны использовать микроскоп, оснащенный кубиком DAPI (возбуждение 377/50 и эмиссия 447/60) и кубиком CY5 (возбуждение 628/40 и эмиссия 685/40). Всю эту информацию мы разместили на сайте Программа просмотра спектров флуоресценции и получили спектры для обоих красителей, а также полосы пропускания для обоих кубов (посмотрите спектр на инфографике выше).
Этот гипотетический очерк является хорошим примером, когда спектры флуорофоров находятся внутри фильтров возбуждения и испускания, что позволяет исследователю снять свои образцы наилучшим образом.
Теперь пора отправиться в лабораторию и применить все на практике!
Надеюсь, эти советы помогут вам в вашем следующем лабораторном эксперименте. Удачи!
Ссылки:
- Введение во флуоресцентную микроскопию. Nikon's MicroscopyU https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Accessed 2021-04-11 17:20:40.

Подпишитесь на нашу рассылку
Эксклюзивный высококачественный контент об эффективных визуальных
коммуникация в науке.