Значна частина повсякденної роботи науковця полягає у розробці та проведенні експериментів.
Поєднання лабораторних методів дасть відповідь на більшість питань, запропонованих вченими, а робочий процес, який дозволить запропонувати нові методи, залежить від досвіду та кваліфікації вченого.
Для біологів зображення клітин можуть багато сказати про те, що відбувається з процесами та механізмами, які вони вивчають.
Світлова мікроскопія є дуже поширеним методом у біологічних науках.
Використання барвників, антитіл і флуоресцентних зондів дозволяє вченим бачити в мікроскопі клітини, які інакше були б занадто малими, щоб їх можна було побачити і навіть зрозуміти.
Флуоресцентні мікроскопи та використання флуорохромів стало можливим у 1930 році1і сьогодні існує безліч комбінацій флуорохромів для забарвлення білків, органел і структур у клітинах і тканинах.
Флуорохроми (або флуорофори) це молекули, які при збудженні світлом певної довжини хвилі випромінюють світло певної довжини хвилі, яке буде вловлене лінзами мікроскопа і перетворене в реальне зображення.
Поєднання флуоресценції, лінз і камер дозволяє нам отримувати зображення процесів всередині клітин у різних ракурсах і аспектах.
Наприклад, за допомогою мікроскопа ми можемо розглянути зріз мозку миші в 2,5-кратному або 4-кратному об'єктиві, а також дрібні деталі досліджуваного актинового цитоскелету в тому ж зразку за допомогою 63-кратного об'єктива.
Для проведення цих аналізів ми можемо використовувати антитіла або барвники проти специфічних білків, присутніх у клітині або тканині, а антитіла зазвичай мають флуорофор.
Зсув Стокса пояснює це явище: флуорофори втрачають енергію коливань у вигляді випромінюваного світла, коли вони переходять зі збудженого стану назад в основний. Флуоресцентні мікроскопи забезпечують світло для збудження флуорофора і приймають його випромінювання. Випромінюване світло може бути вловлене об'єктивом, оброблене в CCD-камері і перетворене в цифрове зображення.
Але про отримання зображень клітин поговоримо пізніше. Зараз ми пропонуємо вам ознайомитися з прикладами та порадами щодо основних кроків перед отриманням зображення.
Як ми обираємо та комбінуємо різні типи барвників та антитіл, щоб побачити та зрозуміти взаємозв'язки між органелами та білками всередині клітин чи тканин?
По-перше, вчені повинні визначити, які антитіла та барвники використовувати на основі своїх досліджень.
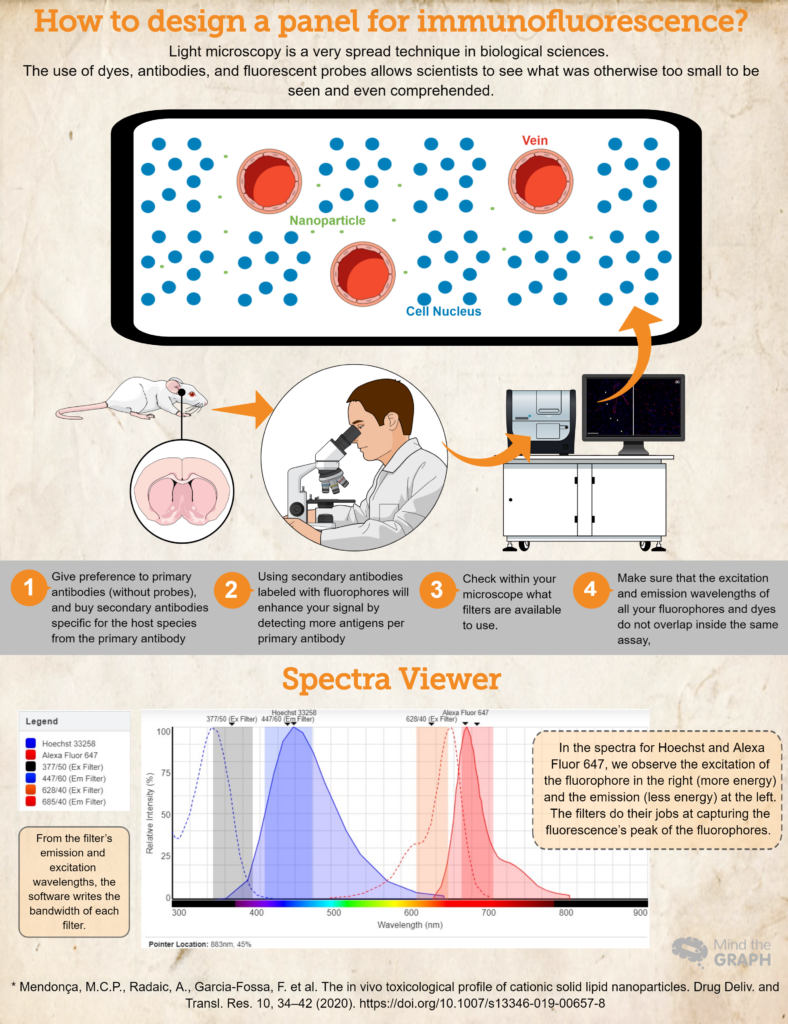
Наприклад, у цій статтіМендонса намагався оцінити ефекти та потенційні ризики катіонних твердих ліпідних наночастинок (КТЛН) на щурах. Багато наночастинок розробляються і вивчаються щороку з метою покращення доставки ліків або генів для лікування багатьох захворювань. Одне з цікавих питань у цьому дослідженні полягало в тому, чи можуть наночастинки досягти мозку, перетнувши гематоенцефалічний бар'єр. Цей бар'єр захищає наш мозок від циркулюючих токсинів або патогенних мікроорганізмів, і зазвичай не бажано, щоб молекули перетинали цей бар'єр. Але в цьому конкретному випадку, "У Мендонси Мета полягала в тому, щоб наночастинки подолали бар'єр і досягли мозку, щоб доставити ліки або гени для майбутніх застосувань.
Бажаючи побачити, чи були наночастинки присутні в паренхімі мозку, автори використовували маркер ендотеліальних клітин для судин під назвою RECA-1 (представлений червоним кольором), в той час як ядра клітин фарбували барвником DAPI (4′,6-діамідино-2-феніліндол), який має синій колір. Ми також можемо спостерігати маленькі зелені точки для наночастинок поза судинами, що означає, що вони досягли паренхіми мозку.
Ознайомтеся з інфографікою нижче з відповідним зображенням.
Давайте розберемося, що роблять антитіла до RECA-1 (червоного кольору).
Ці антитіла призначені для того, щоб слугувати специфічними зондами, і вони націлені на певний антиген (у нашому випадку - білок RECA-1).
Вони можуть бути мічені флуорофором або розпізнані пізніше вторинним антитілом, зв'язаним з флуорофором.
Тому після збудження зразка джерелом світла, специфічний білок, який ви шукаєте, буде розпізнаний у вашому зразку за випромінюванням світла певної довжини хвилі.
У випадку DAPI, цей барвник є контрзабарвником ядер і нуклеосом, і він випромінює синю флуоресценцію при зв'язуванні з АТ-областями ДНК.
Як розробити панель для імунофлуоресценції?
Почніть з цих кроків:
- Купуйте (або позичайте! Наука має бути дуже колаборативною!) антитіла і барвники, необхідні для вашого дослідження. Надавайте перевагу первинним антитілам (без зондів), а вторинні антитіла, специфічні для виду хазяїна, купуйте з первинних антитіл. Наприклад, якщо ви використовуєте первинне антитіло, вироблене на кроликах, використовуйте вторинне антитіло проти кроликів. Це гарантуватиме специфічність.
- Використання вторинних антитіл, мічених флуорофором, посилить ваш сигнал за рахунок виявлення більшої кількості антигенів на одне первинне антитіло. Крім того, це більш динамічний спосіб розробки різних аналізів, оскільки він дозволяє досліднику змінювати кольори на панелі відповідно до своїх потреб.
- Ще одним важливим кроком є перевірка того, які фільтри можна використовувати у вашому мікроскопі. Ви повинні переконатися, що довжини хвиль збудження та випромінювання флуорофора знаходяться в межах фільтрів збудження та випромінювання; в іншому випадку ви не зможете вловити випромінювання від ваших зондів. Ви можете використовувати Переглядач флуоресцентних спектрів щоб перевірити сумісність.
- Переконайтеся, що довжини хвиль збудження і випромінювання всіх ваших флуорофорів і барвників не перетинаються в одному аналізі, Переглядач флуоресцентних спектрів це чудовий вибір. Вони охоплюють майже всі доступні флуорофори!
Наостанок розглянемо приклад гіпотетичного експерименту, в якому ми використовуємо Hoechst 33258 для нуклеїнових кислот і первинне антитіло проти RECA-1, мічене вторинним антитілом Alexa Fluor 647.
В ідеалі ми б використовували мікроскоп з кубом DAPI (збудження 377/50 і випромінювання 447/60) і кубом CY5 (збудження 628/40 і випромінювання 685/40). Всю цю інформацію ми розмістили на сайті Переглядач флуоресцентних спектрів і отримали спектри для обох барвників, а також ширину смуги пропускання для обох кубів (див. спектр на інфографіці вище).
Це гіпотетичне есе є гарним прикладом, де спектри флуорофорів знаходяться всередині фільтрів збудження та випромінювання, що дозволяє досліднику зафіксувати свої зразки найкращим чином.
А тепер час вирушати до лабораторії та застосувати все це на практиці!
Сподіваюся, ці поради допоможуть вам у наступному лабораторному експерименті. Щасти вам!
Посилання:
- Вступ до флуоресцентної мікроскопії. Nikon MicroscopyU https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Доступно з 2021-04-11 17:20:40.

Підпишіться на нашу розсилку
Ексклюзивний високоякісний контент про ефективну візуальну
комунікація в науці.