Kreft har lenge vært en vanskelig og mangfoldig sykdom som skyldes endringer i individets DNA som aktiverer onkogener og inaktiverer tumorundertrykkere, og som også forårsaker dysregulering av epigenomet, som har ansvaret for å koordinere normalt genuttrykk.
To summarize, cancer is a cell illness that causes changes in metabolism and cell structure, causing these cells to become corrupted to the point where they no longer function properly and evading the host’s defense mechanisms.
Et stort antall eksperter og fagpersoner har viet karrieren sin til å forske på kreft for å få en fullstendig forståelse av kreftsykdommens kompleksitet og uklarheter. Kunnskap om hvordan genomet endrer seg, hvordan cellen tilpasser seg og hvordan sykdommen oppstår, er en av de avgjørende faktorene for å utvikle mer effektive behandlingsvalg og forbedre resultatene for kreftpasienter.
CRISPR therapy has established itself as a technique for investigating cell function, and it has had a significant influence on cancer research, resulting in new findings that are expected to speed up diagnosis and treatments.
Hva er CRISPR-terapi?
Siden forskere oppdaget at endringer i DNA forårsaker kreft, har de vært på utkikk etter en metode for å fikse slike endringer ved hjelp av DNA-manipulering. En metode de har funnet, er CRISPR-terapi.
CRISPR-behandling kan redigere DNA-et i menneskeceller på samme måte som en ekstremt nøyaktig og letthåndterlig saks. CRISPR redigerer gener ved å klippe forsiktig i DNA og deretter systematisk la DNA-et repareres.

Hvordan fungerer CRISPR-terapi?
The CRISPR technique in the lab includes two key figures: a guide RNA and a DNA-cutting enzyme, most often Cas9.
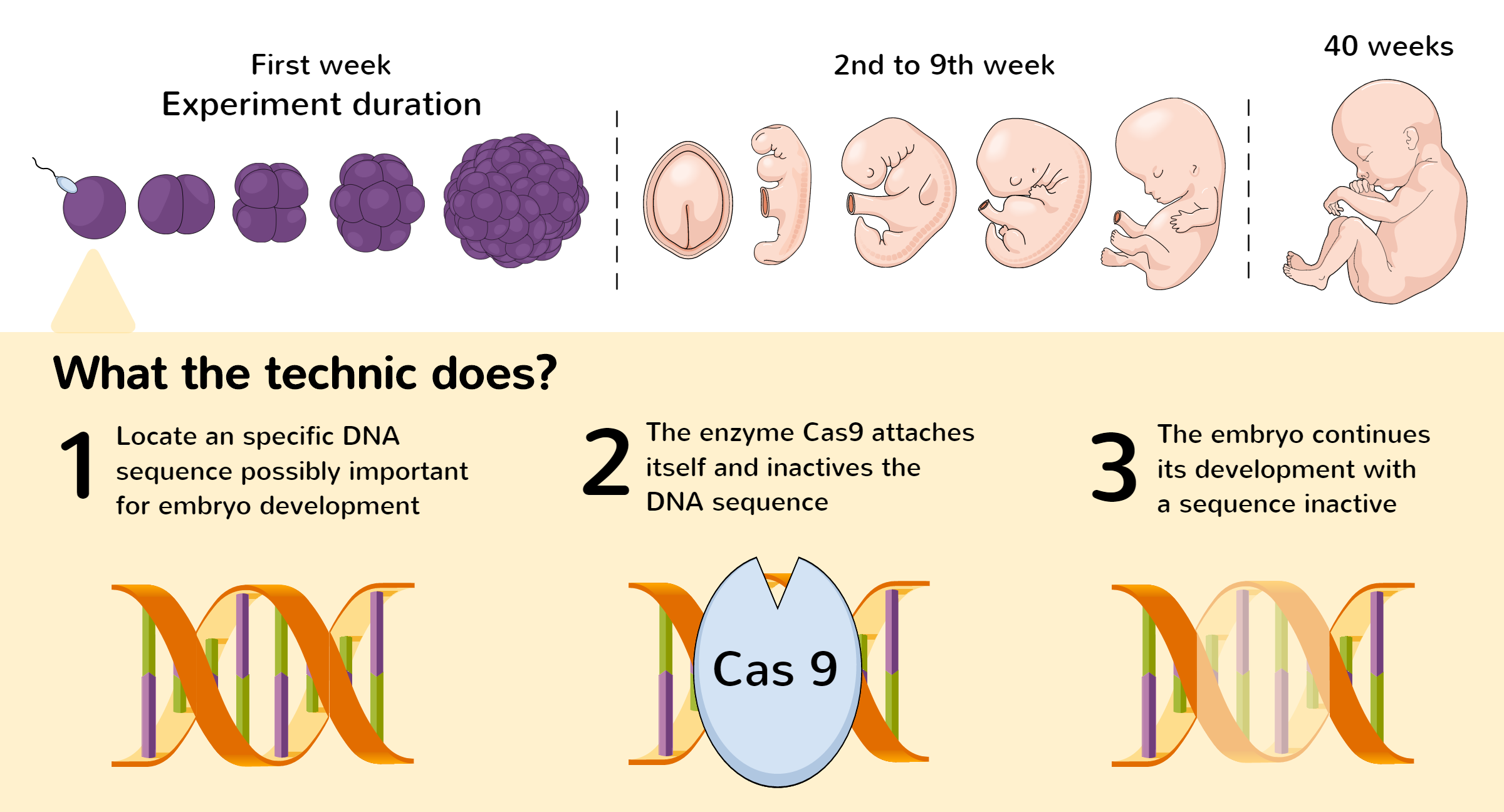
For å kunne bruke den genetiske saksen CRISPR til å endre et genom, må DNA-sekvensen som skal endres, først lokaliseres. Når den aktuelle DNA-sekvensen er identifisert, skal et enkelt guide-RNA (sgRNA) gjenkjenne og koble seg til den.
Guide-RNA-sekvensen er komplementær til mål-DNA-sekvensen. Det betyr at guide-RNA-et ideelt sett bare kobles til mål-DNA-sekvensen og ikke til andre deler av genomet.
The Cas9 enzyme (molecular scissor protein) connects to the RNA and guides the scissors to the exact spot in the genome where the cut needs to be performed.
Denne reparasjonsprosessen kan styres ved å endre DNA-et på det aktuelle stedet i genomet. Et gen kan for eksempel fjernes eller oppdateres for å reparere eventuelle feil i sekvensen.
Avhengig av hvordan CRISPR-systemet er programmert, er det tre mulige utfall når målsekvensen er kuttet:
- En mutasjon i DNA-et introduseres for å hele kuttet.
- Enzymer er designet for å produsere kutt på begge sider av mål-DNA-et for å fjerne mål-DNA-et og koble endene sammen igjen.
- Et segment av HDR kan settes inn i genomet ved homolog rekombinasjon.

Hvilke bekymringer er knyttet til CRISPR?
- Getting CRISPR inside cells is a challenge. The scientists discovered a technique to accomplish so by using a virus that has been mutated to carry genes for guide RNA and Cas9. Because certain viruses may infect various types of cells, they may wind up altering, for example, muscle cells when the intention was liver cells.
- CRISPR har nettopp blitt testet på mennesker, og forskerne er bekymret for hvordan kroppen og immunforsvaret kan reagere på virus som inneholder CRISPR, eller på selve CRISPR-elementene. Fordi elementene er ukjente for mennesker, kan immunforsvaret angripe og ødelegge CRISPR-redigerte celler.
- CRISPR bryter av og til DNA utenfor målgenet, noe som kalles "off-target"-kutting. Forskere er bekymret for at slike utilsiktede endringer kan være for skadelige og til og med kreftfremkallende.
- Et annet viktig problem er at modifisering av celler i kroppen kan føre til utilsiktede endringer i sæd- eller eggceller som kan gå i arv til fremtidige generasjoner.
Etiske spørsmål
CRISPR-behandling reiser også etiske problemstillinger. Nedenfor kan du lese om noen av de etiske betenkelighetene:
- Som tidligere nevnt kan celleforandringer i kroppen feilaktig påvirke sæd- eller eggceller, noe som kan gå i arv til kommende generasjoner. I stedet for å helbrede sykdom kan disse endringene hypotetisk sett utnyttes til å forbedre ønskelige egenskaper.
- Mange har moralske og religiøse motforestillinger mot bruk av menneskelige embryoer i forskning. Generelt kan embryoforskning involvere levedyktige eller ikke-levedyktige embryoer som er til overs etter IVF, eller embryoer som er generert spesielt for studien. Hvert tilfelle har sine egne etiske betenkeligheter.
- Det er bekymring for at genomredigering vil være begrenset til de rike, noe som vil forverre de eksisterende forskjellene i tilgang til helsetjenester og andre behandlingsformer.
Ikke kast bort tiden! En plattform som er enkel å bruke, og som alle kan bruke.
Bruk et brukervennlig verktøy til å lage imponerende infografikk, illustrasjoner eller til og med forvandle arbeidet ditt til en flott og forståelig plakat. Se opp for grafen er det rette verktøyet for deg; du kan bruke maler eller til og med be om en som passer akkurat slik du har tenkt deg!

Abonner på nyhetsbrevet vårt
Eksklusivt innhold av høy kvalitet om effektiv visuell
kommunikasjon innen vitenskap.