Una gran parte de la rutina del científico consiste en diseñar y realizar experimentos.
La combinación de técnicas de laboratorio responderá a la mayoría de las preguntas propuestas por los científicos, y el flujo de trabajo para sugerir nuevos métodos depende de la formación y la experiencia del científico.
Para los biólogos, las imágenes de las células pueden decir mucho sobre lo que ocurre con los procesos y mecanismos que estudian.
Microscopía óptica es una técnica muy extendida en las ciencias biológicas.
El uso de tintes, anticuerpos y sondas fluorescentes permite a los científicos ver en las células del microscopio imágenes de lo que de otro modo sería demasiado pequeño para ser visto e incluso comprendido.
Microscopios de fluorescencia y el uso de fluorocromos fue posible en 19301Hoy en día es posible realizar muchas combinaciones de fluorocromos para teñir proteínas, orgánulos y estructuras dentro de las células y los tejidos.
Fluorocromos (o fluoróforos) son moléculas que, al ser excitadas con una longitud de onda específica, emiten luz de una longitud de onda definida que será captada por las lentes de un microscopio, y transformada en una imagen real.
La combinación de fluorescencia, lentes y cámaras nos permite tomar una imagen de los procesos en el interior de las células en muchas vistas y aspectos diferentes.
Por ejemplo, utilizando el microscopio, tenemos una visión más amplia de un corte de cerebro de ratón en un objetivo de 2,5x o 4x, y pequeños detalles del citoesqueleto de actina sondeado en la misma muestra utilizando un objetivo de 63x.
Para realizar estos ensayos, podemos utilizar anticuerpos o colorantes contra proteínas específicas presentes en la célula o el tejido, y el anticuerpo suele llevar un fluoróforo.
El desplazamiento de Stokes explica este fenómeno: los fluoróforos pierden energía vibracional en forma de luz emitida cuando cambian de un estado excitado al estado básico. Los microscopios de fluorescencia proporcionan la luz para excitar el fluoróforo y reciben su luz emitida. La luz emitida puede ser captada por una lente, procesada en una cámara CCD y transformada en una imagen digital.
Pero hablaremos de la adquisición de imágenes de células más adelante. Ahora, debemos presentarle ejemplos y consejos para los principales pasos antes de adquirir su imagen.
¿Cómo elegimos y combinamos diferentes tipos de tintes y anticuerpos para ver y comprender las relaciones entre los orgánulos y las proteínas del interior de las células o los tejidos?
En primer lugar, los científicos tienen que determinar qué anticuerpos y tintes utilizar en función de su investigación.
Por ejemplo, en este artículoEl objetivo de Mendonça era evaluar los efectos y los posibles riesgos de las nanopartículas lipídicas sólidas catiónicas (cSLN) en ratas. Cada año se desarrollan y estudian muchas nanopartículas con el objetivo de mejorar la administración de fármacos o genes para tratar muchas enfermedades. Una de las cuestiones interesantes de este estudio era saber si las nanopartículas eran capaces de llegar al cerebro atravesando la barrera hematoencefálica. Esta barrera protege a nuestro cerebro de las toxinas o patógenos que circulan, y normalmente no es deseable que las moléculas crucen la barrera. Pero en este caso concreto, Mendonça's El objetivo era que las nanopartículas atravesaran la barrera y llegaran al cerebro, para administrar fármacos o genes en una futura aplicación.
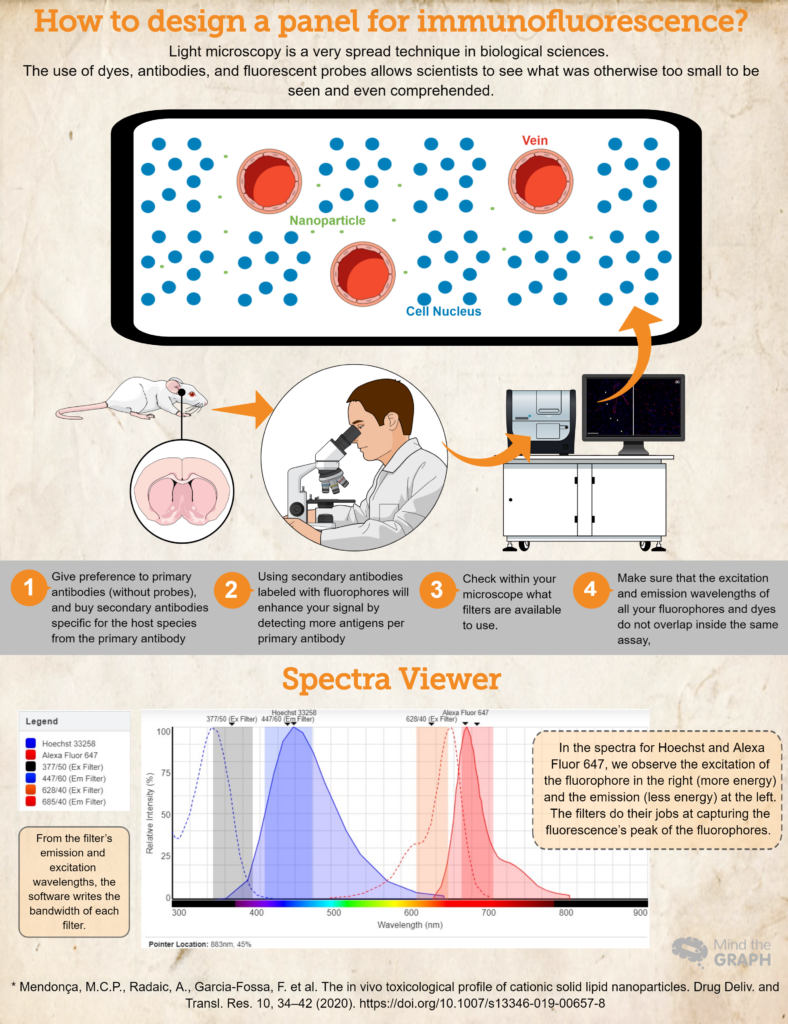
Dispuestos a ver si las nanopartículas estaban presentes en el parénquima cerebral, los autores utilizaron un marcador de células endoteliales para los vasos llamado RECA-1 (representado en rojo), mientras que los núcleos celulares se tiñeron con un colorante llamado DAPI (4′,6-diamidino-2-fenilindol) que es azul. También podemos observar pequeños puntos verdes para las nanopartículas fuera de los vasos, lo que significa que llegaron al parénquima cerebral.
Consulte la infografía siguiente con una imagen de representación.
Entendamos lo que hace el anticuerpo para RECA-1 (rojo).
Estos anticuerpos están diseñados para servir como sondas específicas, y se dirigen a un antígeno concreto (en nuestro caso, la proteína RECA-1).
Pueden ser marcados con un fluoróforo o reconocidos posteriormente por un anticuerpo secundario unido a un fluoróforo.
Por lo tanto, después de excitar la muestra con una fuente de luz, la proteína específica que está buscando será reconocida en su muestra por la emisión de luz en una longitud de onda específica.
En el caso del DAPI, este colorante es un contratinción de núcleos y nucleosomas, y emite fluorescencia azul cuando se une a las regiones AT del ADN.
¿Cómo diseñar un panel de inmunofluorescencia?
Empieza con estos pasos:
- Compre (¡o pida prestado! ¡La ciencia debe ser muy colaborativa!) los anticuerpos y colorantes esenciales para su investigación. Dé preferencia a los anticuerpos primarios (sin sondas) y compre anticuerpos secundarios específicos para la especie huésped del anticuerpo primario. Por ejemplo, si se utiliza un anticuerpo primario producido en conejos, utilice un anticuerpo secundario para el anti-conejo. Esto garantizará la especificidad.
- El uso de anticuerpos secundarios marcados con fluoróforos mejorará su señal al detectar más antígenos por anticuerpo primario. Además, esta es una forma más dinámica de elaborar diferentes ensayos, ya que permite al investigador modificar los colores del panel en función de sus necesidades.
- Otro paso importante es comprobar dentro de su microscopio qué filtros están disponibles para su uso. Debe asegurarse de que las longitudes de onda de excitación y emisión de su fluoróforo se encuentran dentro de los filtros de excitación y emisión; de lo contrario, no podrá capturar la luz de emisión de sus sondas. Puede utilizar Visor de espectros de fluorescencia para comprobar la compatibilidad.
- Para asegurarse de que las longitudes de onda de excitación y emisión de todos sus fluoróforos y colorantes no se superponen dentro del mismo ensayo, Visor de espectros de fluorescencia es una gran elección. Cubren casi todos los fluoróforos disponibles.
Por último, revise un ejemplo para un experimento hipotético donde tenemos Hoechst 33258 para los ácidos nucleicos, y un anticuerpo primario contra RECA-1 marcado con un anticuerpo secundario Alexa Fluor 647.
Lo ideal sería utilizar un microscopio disponible con un cubo de DAPI (excitación 377/50 y emisión 447/60), y un cubo de CY5 (excitación 628/40 y emisión 685/40). Toda esta información la insertamos en Visor de espectros de fluorescencia y obtuvimos los espectros de ambos tintes, así como los anchos de banda de ambos cubos (mira el espectro en la infografía de arriba).
Este ensayo hipotético es un buen ejemplo en el que los espectros de los fluoróforos se encuentran dentro de los filtros de excitación y emisión, lo que permite al investigador captar sus muestras de la mejor manera posible.
Ahora, ¡es el momento de ir al laboratorio y poner todo en práctica!
Espero que estos consejos te ayuden en tu próximo experimento de laboratorio. Buena suerte.
Referencias:
- Introducción a la microscopía de fluorescencia. MicroscopíaU de Nikon https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Consultado el 2021-04-11 17:20:40.

Suscríbase a nuestro boletín de noticias
Contenidos exclusivos de alta calidad sobre la eficacia visual
comunicación en la ciencia.