Голяма част от работата на учените е да проектират и провеждат експерименти.
Комбинацията от лабораторни методи ще даде отговор на повечето въпроси, предложени от учените, а работният процес за предлагане на нови методи зависи от образованието и опита на учените.
За биолозите клетъчните изображения могат да кажат много за това какво се случва с процесите и механизмите, които изучават.
Светлинна микроскопия е много разпространена техника в биологичните науки.
Използването на багрила, антитела и флуоресцентни сонди позволява на учените да видят в клетките на микроскопа изображения на това, което иначе е било твърде малко, за да бъде видяно и дори разбрано.
Флуоресцентни микроскопи и използването на флуорохроми става възможно през 1930 г.1, а днес са възможни много комбинации от флуорохроми за оцветяване на протеини, органели и структури в клетките и тъканите.
Флуорохроми (или флуорофори) са молекули, които при възбуждане с определена дължина на вълната на светлината излъчват светлина с определена дължина на вълната, която се улавя от лещите на микроскопа и се превръща в реално изображение.
Комбинацията от флуоресценция, лещи и камери ни дава възможност да правим снимки на процесите в клетките в много различни гледни точки и аспекти.
Например, използвайки микроскопа, имаме по-широк поглед върху парче мозък на мишка с обектив 2,5х или 4х и малки детайли от изследвания актинов цитоскелет в същата проба с обектив 63х.
За тези анализи можем да използваме антитела или багрила срещу специфични протеини, присъстващи в клетката или тъканта, като антителата обикновено са снабдени с флуорофор.
Преместването на Стокс обяснява това явление: флуорофорите губят вибрационна енергия под формата на излъчена светлина, когато преминават от възбудено състояние обратно в основно състояние. Флуоресцентните микроскопи осигуряват светлина за възбуждане на флуорофора и приемат излъчената от него светлина. Излъчената светлина може да бъде уловена от обектив, обработена в CCD камера и преобразувана в цифрово изображение.
Но нека поговорим за придобиването на клетъчни изображения по-късно. Сега трябва да ви запознаем с примери и съвети за основните стъпки преди придобиването на изображението.
Как избираме и комбинираме различни видове багрила и антитела, за да видим и разберем връзките между органели и протеини в клетките или тъканите?
Първо, учените трябва да определят кои антитела и багрила да използват въз основа на своите изследвания.
Например, в тази статия, Мендонса се опитва да оцени ефектите и потенциалните рискове от катионни твърди липидни наночастици (cSLNs) при плъхове. Всяка година се разработват и изучават много наночастици, чиято цел е да подобрят доставката на лекарства или гени за лечение на много заболявания. Един от интересните въпроси в това проучване е дали наночастиците са в състояние да достигнат до мозъка, като преминат кръвно-мозъчната бариера. Тази бариера предпазва мозъка ни от циркулиращи токсини или патогени и обикновено не е желателно молекулите да преминават бариерата. Но в този конкретен случай, Mendonça's Целта е наночастиците да преминат бариерата и да достигнат до мозъка, за да доставят лекарства или гени в бъдеще.
В желанието си да проверят дали наночастиците присъстват в мозъчния паренхим, авторите използват маркер на ендотелните клетки за съдовете, наречен RECA-1 (представен в червено), а клетъчните ядра са оцветени с багрило, наречено DAPI (4′,6-диамидино-2-фенилиндол), което е синьо. Можем да наблюдаваме и малки зелени точки за наночастиците извън съдовете, което означава, че те са достигнали до мозъчния паренхим.
Разгледайте инфографиката по-долу с изображението за представяне.
Нека разберем какво прави антитялото за RECA-1 (червено).
Тези антитела са проектирани да служат като специфични сонди и са насочени към специфичен антиген (в нашия случай - протеина RECA-1).
Те могат да бъдат маркирани с флуорофор или разпознати по-късно от вторично антитяло, свързано с флуорофор.
Затова след възбуждане на пробата със светлинен източник, специфичният протеин, който търсите, ще бъде разпознат в пробата ви чрез излъчване на светлина с определена дължина на вълната..
В случая с DAPI това багрило е контрастайн за ядра и нуклеозоми и излъчва синя флуоресценция, когато се свърже с АТ-области на ДНК.
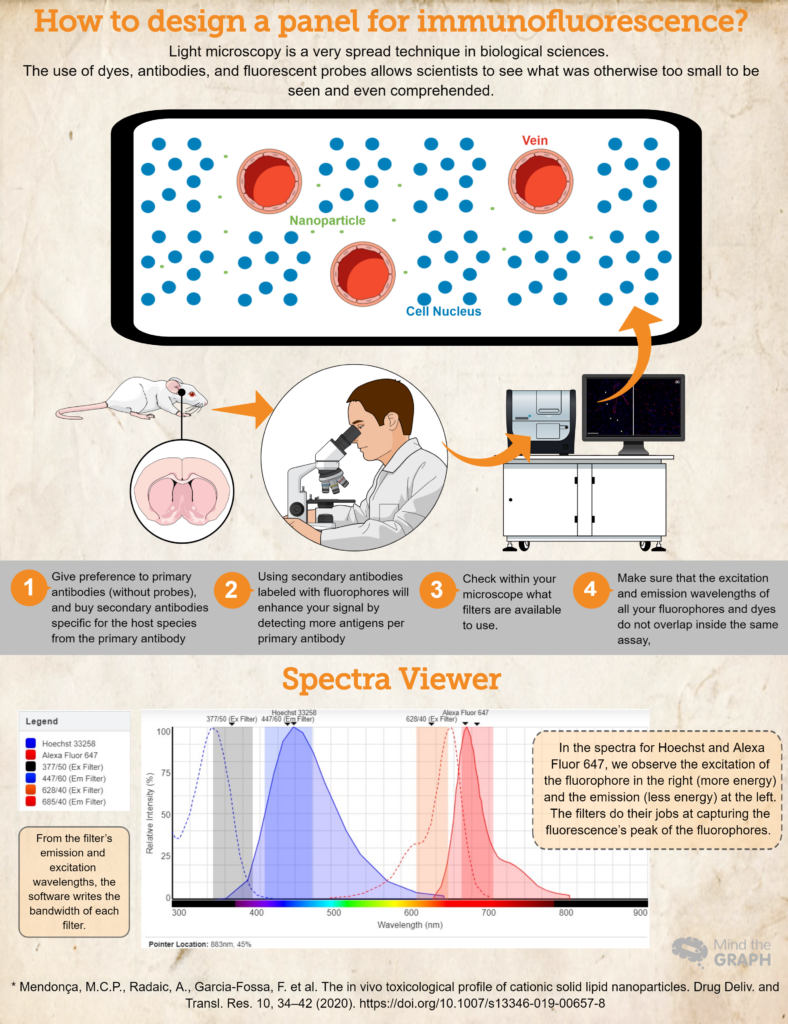
Как да създадем панел за имунофлуоресценция?
Започнете с тези стъпки:
- Купете (или вземете назаем! Науката трябва да бъде много съвместна!) антитела и багрила, необходими за вашите изследвания. Отдавайте предпочитание на първичните антитела (без сонди) и купувайте вторични антитела, специфични за вида гостоприемник от първичното антитяло. Например, ако използвате първично антитяло, произведено при зайци, използвайте вторично антитяло за анти-зайци. Това ще гарантира специфичност.
- Използването на вторични антитела, маркирани с флуорофори, ще подобри сигнала ви, като открие повече антигени на едно първично антитяло. Освен това това е по-динамичен начин за разработване на различни анализи, тъй като позволява на изследователя да променя цветовете в панела в зависимост от нуждите си.
- Друга важна стъпка е да проверите в микроскопа си какви филтри можете да използвате. Трябва да се уверите, че дължините на вълните на възбуждане и излъчване на вашите флуорофори попадат във филтрите за възбуждане и излъчване; в противен случай няма да можете да уловите емисионната светлина от вашите сонди. Можете да използвате Преглед на флуоресцентни спектри за да проверите съвместимостта.
- За да сте сигурни, че дължините на вълните на възбуждане и излъчване на всички ваши флуорофори и багрила не се припокриват в един и същи тест, Преглед на флуоресцентни спектри е чудесен избор. Те покриват почти всички налични флуорофори!
И накрая, проверете пример за хипотетичен експеримент, в който имаме Hoechst 33258 за нуклеиновите киселини и първично антитяло срещу RECA-1, маркирано с вторично антитяло Alexa Fluor 647.
В идеалния случай бихме използвали микроскоп с кубче DAPI (възбуждане 377/50 и излъчване 447/60) и кубче CY5 (възбуждане 628/40 и излъчване 685/40). Цялата тази информация е поместена в Преглед на флуоресцентни спектри и получих спектрите на двете багрила и ширината на честотната лента за двата куба (вижте спектъра в инфографиката по-горе).
Този хипотетичен есемес е добър пример, при който спектрите на флуорофорите попадат във възбуждащия и емисионния филтър, което дава възможност на изследователя да улови пробите си по най-добрия възможен начин.
Сега е време да отидете в лабораторията и да приложите всичко на практика!
Надявам се тези съвети да ви помогнат при следващия ви лабораторен експеримент. Успех!
Препратки:
- Въведение във флуоресцентната микроскопия. Микроскопия на NikonU https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Достъпно на 2021-04-11 17:20:40.

Абонирайте се за нашия бюлетин
Ексклузивно висококачествено съдържание за ефективни визуални
комуникация в областта на науката.